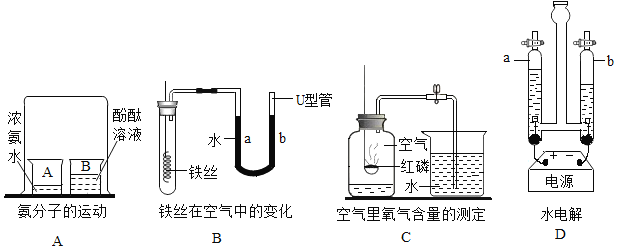
题目内容
【题目】某兴趣小组取碳酸钙与盐酸反应后的废液进行了以下实验:取澄清废液160g于烧杯中,向其中逐渐加入溶质质量分数为10%的碳酸钠溶液,烧杯中混合溶液的质量与所滴入Na2CO3,溶液的质量关系曲线如图所示:
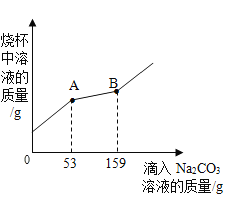
(1)求160g混合液中氯化钙的质量。
(2)当滴入Na2CO3溶液至图中A点时,此时所得溶液中氯化钠的质量分数。(计算结果精确到0.1%)
【答案】(1)11.1g;(2)2.8%
【解析】
到A点盐酸完全反应,B点氯化钙和碳酸钠完全反应,之后碳酸钠过量。根据碳酸钠的质量和对应的化学方程式求算160g混合液中氯化钙的质量;进而结合与盐酸反应碳酸钠的质量求算氯化钠的质量以及生成的二氧化碳的质量,然后求算对应的质量分数。
解:(1)到A点盐酸完全反应,B点氯化钙和碳酸钠完全反应,之后碳酸钠过量。即与盐酸反应的碳酸钠溶液的质量为53g,与氯化钙反应的碳酸钠溶液的质量为159g﹣53g=106g;则与氯化钙反应的碳酸钠的质量为106g×10%=10.6g;设氯化钙的质量为x,
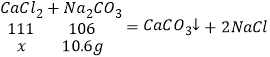
![]()
x=11.1g,
(2)设盐酸对应生成氯化钠的质量为z,生成二氧化碳的质量为y,
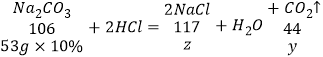
![]() y=2.2g,
y=2.2g,
![]() z=5.85g,
z=5.85g,
当滴入Na2CO3溶液至图中A点时,此时所得溶液中氯化钠的质量分数为![]() ×100%≈2.8%;
×100%≈2.8%;
答:(1)10g混合液中氯化钙的质量为11.1g;
(2)当滴入Na2CO3溶液至图中A点时,此时所得溶液中氯化钠的质量分数2.8%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】今天是某校实验室开放日,晓明同学用锌和稀硫酸反应制取氢气。先向气体发生装置中加入一定量的锌粒,然后将60克稀硫酸分三次加入,每次生成气体的质量如下表:
次数 | 第一次 | 第二次 | 第三次 |
加入稀硫酸质量/g | 20 | 20 | 20 |
生成氢气的质量/g | 0.08 | 0.08 | 0.04 |
试计算:
(1)共制得氢气_____g和共加入_____g锌粒。
(2)实验所用稀硫酸中溶质的质量分数。_____(写出计算过程)
【题目】下表是元素周期表的一部分,则下列回答不正确的是( )
11Na 纳 | 12Mg 镁 | 13Al 铝 | 14Si 硅 | 15P 磷 | 16S 硫 | 17Cl 氯 | 18Ar 氩 |
A. 12号元素的离子符号Mg+2
B. 硫原子的核外电子排布为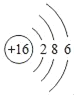
C. 硅元素位于周期表的第三周期
D. 13号元素是地壳中含量最多的金属元素