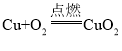
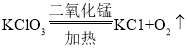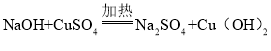题目内容
【题目】化学与我们的生产生活密切联系。
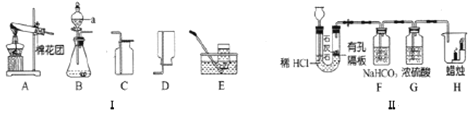
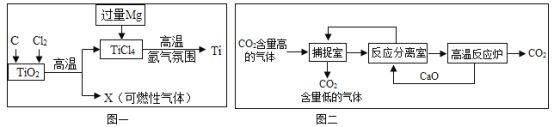
(1)目前大规模生产钛的流程如图一所示。
钛的性质:①常温下,钛既不与常见非金属单质反应、也不和强酸反应:
②加热时,却可以和常见的非金属单质反应。
第一步:使TiO2与C混合,在高温条件下反应,再通入Cl2,制得TiCl4和一种可燃性气体X,推测X的化学式_____。
第二步:在氩气的气流中,高温下用过量的Mg和TiCl4发生置换反应制得钛。写出此反应的化学方程式_____,该过程中氩气用做保护气,防止_____。上述反应制得的金属钛往往会混有_____,可以用_____试剂除去(填试剂名称)。
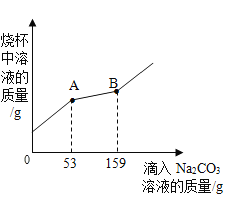
(2)”碳捕捉技术“是指通过一定方法,将工业生产中产生的CO2分离出来进行储存和利用。常利用NaOH溶液在捕捉室中”捕捉“CO2”,其过程如图二所示。
①捕提室中发生反应的化学方程式为_____。
②对于该方法,下列说法正确的是_____(填字母序号)。
a该方法不消耗能源可减少碳排放 b反应分离室内中发生的都是复分解反应
c反应分离室中分离物质的方法是结晶 d该流程中有两种物质在循环利用
【答案】CO 2Mg+TiCl4![]() Ti+2MgCl2 在高温下钛与氧气等非金属单质反应 镁 盐酸 CO2+2NaOH=Na2CO3+H2O d
Ti+2MgCl2 在高温下钛与氧气等非金属单质反应 镁 盐酸 CO2+2NaOH=Na2CO3+H2O d
【解析】
(1)根据质量守恒定律在化学反应前后,元素的种类不变推断X的化学式;氩气属于稀有气体常用于保护气;根据在氩气的气流中,高温下过量的Mg和TiCl4发生的置换反应写出反应的方程式。根据制取钛的过程分析常混入的金属杂质,根据物质的性质分析除去的方法;
(2)根据二氧化碳与氢氧化钠反应的反应物、生成物写出化学方程式;根据题中信息进行判断。
(1)第一步:由于TiO2、C、Cl2混合物在高温条件下制得TiCl4和一种可燃性气体,根据化学反应中元素种类不变的规律可知:该可燃气体含有碳、氧两种元素,由碳、氧两种元素组成的可燃物只有一氧化碳,化学式是:CO;
第二步:在氩气的气流中,高温下用过量的Mg和TiCl4发生置换反应制得钛。此反应的化学方程式:2Mg+TiCl4![]() Ti+2MgCl2;由于氩气属于稀有气体,性质很稳定,常用作保护气,防止在高温下钛与氧气等非金属单质反应。由制取钛的过程可知,要加入过量的镁,所以,混有另外一种金属单质杂质为镁。由于镁能与盐酸反应,钛不与盐酸反应,可用盐酸除去;
Ti+2MgCl2;由于氩气属于稀有气体,性质很稳定,常用作保护气,防止在高温下钛与氧气等非金属单质反应。由制取钛的过程可知,要加入过量的镁,所以,混有另外一种金属单质杂质为镁。由于镁能与盐酸反应,钛不与盐酸反应,可用盐酸除去;
(2)①捕捉室中发生反应的化学反应是二氧化碳和氢氧化钠溶液反应生成碳酸钠和水,其化学方程式为CO2+2NaOH=Na2CO3+H2O;
②a.因为二氧化碳是造成温室效应的主要气体之一,捕捉到的CO2可制备其它化工产品,从而减少了温室气体排放,但需要消耗能源,故错误;
b.反应分离室内氧化钙与水反应生成氢氧化钙,属于化合反应,故错误;
c.反应分离室中分离物质的方法是过滤,故错误;
d.碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,氢氧化钠又是捕捉室中的反应物,所以可以循环利用;碳酸钙高温生成氧化钙和二氧化碳,观察图示,氧化钙还可循环利用,氧化钙和氢氧化钠都可以循环利用,故正确。

【题目】钠是一种活泼金属,常温下能与氧气、水等物质发生反应。钠与水反应的化学方程式为:2Na+2H2O==2NaOH+H2↑。在实验室,小亮先取定量的硫酸铜溶液于烧杯中,再取一小块钠投入硫酸铜溶液中,充分反应后过滤,得到滤液和蓝色滤渣,并对滤被的成分进行探究。
(提出问题)滤液中溶质的成分是什么?
(查阅资料)Na2SO4溶液呈中性
(猜想与假设)猜想一:Na2SO4
猜想二:Na2SO4和NaOH
猜想三:____________
猜想四:Na2SO4、CuSO4和NaOH
小明认为猜想______不合理,理由是_______(用化学方程式表示)。
(实验与验证)
实验 | 实验操作 | 实验現象 | 实验结论 |
实验一 | 取少量滤液于试管中,仔细观察现象 | 溶液为无色 | 猜想_____不成立 |
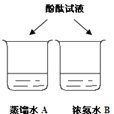
实验二 | 向实验一所取滤液中滴入酚酞溶液 | ________ | 猜想二不成立 |
实验三 | 常温下,再取少量滤液,测溶液酸碱度 | pH=7 | 猜想_____成立 |
(拓展延伸)金属活动性顺序表中钠及前面的金属____(填“能”或“不能”)把位于后面的金属从它们盐溶液里置换出来。