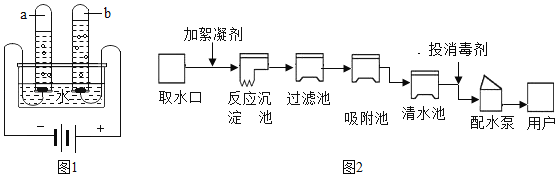
��Ŀ����
����Ŀ��ij��ȤС��ͬѧ��ʵ�����Ʊ���������������̽��ʵ�顣
��1��Ϊ̽�����������������طֽ��ٶȵ�Ӱ�죬����ƶԱ�ʵ�飺
��3.0g�������1.0g�������̾��Ȼ�ϼ��ȣ�
��xg�������1.0g����ͭ���Ȼ�ϼ��ȡ�
����ͬ�¶��£��Ƚ�����ʵ����������Ŀ�����
���з�Ӧ�ķ��ű���ʽ��_____������x��ֵӦΪ_____
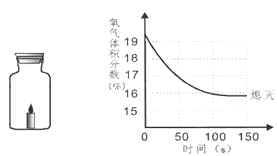
��2����̽����Ӱ��˫��ˮ�ֽ��ٶȵ�ij�����ء�ʵ�����ݼ�¼���£�
˫��ˮ��������g�� | ˫��ˮ��Ũ�� | �������̵�������g�� | ��ͬʱ���ڲ��������������mL�� | |
�� | 50.0 | 1% | 0.1 | 9 |
�� | 50.0 | 2% | 0.1 | 16 |
�� | 50.0 | 4% | 31 |
��ȡ�ö������̵�������_____��ʵ����У�����������̵�����Ϊ_____g��
��ʵ����ۣ�����ͬ�����£�_____��˫��ˮ�ֽ��Խ�졣
���𰸡�2KClO3![]() 2KCI+3O2�� 3.0 ҩ�� 0.1 ˫��ˮŨ��Խ��
2KCI+3O2�� 3.0 ҩ�� 0.1 ˫��ˮŨ��Խ��
��������
����غͶ������̼��������Ȼ��غ�������
��1���������֪�����м�������غͶ������̵Ļ������ȡ��������Ӧ�Ļ�ѧ����ʽ�ǣ� 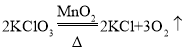 ����������ص�������Ȳ��ܱȽϳ��������̺�����ͭ�Ĵ�Ч��������ҲӦ��ȡ3.0g����أ��ʢ���x��ֵӦΪ3.0��
����������ص�������Ȳ��ܱȽϳ��������̺�����ͭ�Ĵ�Ч��������ҲӦ��ȡ3.0g����أ��ʢ���x��ֵӦΪ3.0��
��2�������������ǹ���ķ�ĩ��ȡ�ö������̵�������ҩ�ף�ʵ����У��ɿ��Ʊ�������֪������������̵�������ͬ���ܱȽϲ�ͬŨ�ȵ�˫��ˮ�������������ʡ�
��������ʵ�����ݿ�֪���ڶ������̵�������ͬʱ��˫��ˮ��Ũ��Խ���������������Խ�࣬�ɴ˿ɵó�ʵ����ۣ�����ͬ�����£�˫��ˮŨ��Խ��˫��ˮ�ֽ��Խ�졣

 ������ѧ���̲���ȫ���ϵ�д�
������ѧ���̲���ȫ���ϵ�д� ������ʱ����ҵ����ϵ�д�
������ʱ����ҵ����ϵ�д�