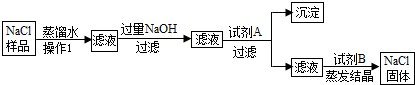
��Ŀ����
̼�����Ƴ�����ʳƷ��ҽҩ��ҵ��ij��ѧ��ȤС���̼�����ƽ���̽����
���������ϡ� ��̼�������������ֽ⣬����ˮ��������̼�����һ�ֳ����Ĺ������ʡ�
��̼������Һ�ʼ��ԡ�
������ʵ�顿Ϊ����֤̼����������ʱ��ֽ⣬��ȤС���ͬѧȡһ��������̼�����Ƶ�ͭƬ�ϼ��ȣ���ͼ��ʾ��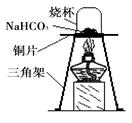
��1������һ��ʱ��۲쵽�ձ��ڱ���__________��
��2����ּ��Ⱥ��ձ�Ѹ�ٵ�ת���������������ij���ʯ��ˮ�����۲쵽ʯ��ˮ����ǡ�д���÷�Ӧ�Ļ�ѧ����ʽ��___________________��
��3����ȤС���ͬѧ��Ϊ����ּ��Ⱥ�Ĺ�����������NaOH��Na2CO3��
�����ǵ�������____________________________________��
����ȤС��Ϊ��ȷ����Ӧ��Ĺ������ɷֽ�������ʵ�飬����д�±���
| ʵ�� | ʵ������ | ���� |
| ʵ��һ��ȡ������Ӧ��Ĺ����������ˮ�����뼸�η�̪��Һ | ��Һ��ɺ�ɫ | ���������NaOH��������Na2CO3 |
| ʵ�����ȡ������Ӧ��Ĺ����������ˮ�������Ȼ�����Һ | _____________ | ���������Na2CO3��������NaOH |
| ʵ������___________________ ___________________________ | ������������ | ���������Na2CO3��������NaOH |
�����������ۡ�ʵ��һ�Ľ�����ʵ�����ʵ�����Ľ����෴��������ʱ��ȤС���ͬѧ��Ϊ����һ�Ľ��۲���ȷ�����ǵ�������_____________________________________________��
���ܽ��д��̼���������ȷֽ�Ļ�ѧ����ʽ________________________��
��4��ij�����Ҫ��Ʒ֮һ��С�մ�̼�����ƣ���Ϊ�˲ⶨ��Ʒ��̼�����Ƶ������������������Ʒ��ֻ���Ȼ���һ�����ʣ���ȡ��Ʒ10��0 g��μ���ϡ���ᣬ�������������Ϊ4��4 g������Ʒ��̼�����Ƶ�����������
������ʵ�顿��1��ˮ�飨2��CO2 + Ca(OH)2=CaCO3��+ H2O��3���ٸ��������غ㶨�ɣ���ѧ��Ӧǰ��Ԫ������䡣�ڲ�����ɫ���� ��ȡ������Ӧ��Ĺ����������ˮ������ϡ��������������ۡ�̼������Һ�ʼ��ԣ�Ҳ�ܹ۲쵽��Һ��ɺ�ɫ�������ܽ2NaHCO3 Na2CO3 + H2O + CO2����4��84%
Na2CO3 + H2O + CO2����4��84%
������������������������ṩ�����Ͽ�֪��1������һ��ʱ��۲쵽�ձ��ڱ���ˮ����֣���2����ּ��Ⱥ��ձ�Ѹ�ٵ�ת���������������ij���ʯ��ˮ�����۲쵽ʯ��ˮ����ǡ��÷�Ӧ�Ļ�ѧ����ʽ��CO2 + Ca(OH)2=CaCO3��+ H2O����3����ȤС���ͬѧ��Ϊ����ּ��Ⱥ�Ĺ�����������NaOH��Na2CO3�����ǵ������Ǹ��������غ㶨�ɣ���ѧ��Ӧǰ��Ԫ������䡣����ȤС��Ϊ��ȷ����Ӧ��Ĺ������ɷֽ�������ʵ���������Ϊ��������ɫ���� ��ȡ������Ӧ��Ĺ����������ˮ������ϡ��������������ۡ�ʵ��һ�Ľ�����ʵ�����ʵ�����Ľ����෴��������ʱ��ȤС���ͬѧ��Ϊ����һ�Ľ��۲���ȷ�����ǵ�������̼������Һ�ʼ��ԣ�Ҳ�ܹ۲쵽��Һ��ɺ�ɫ������ ���ܽ��д��̼���������ȷֽ�Ļ�ѧ����ʽ2NaHCO3 Na2CO3 + H2O + CO2��
Na2CO3 + H2O + CO2��
(4)����Ʒ��̼�����Ƶ�����Ϊx
2NaHCO3 Na2CO3 + H2O + CO2��
Na2CO3 + H2O + CO2��
168 44
X 4��4g
168��44=X��4��4g
X=8��4g
8��4g/10g��100%=84%
����Ʒ��̼�����Ƶ���������Ϊ84%
���㣺�ɷ�̽�������ݻ�ѧ����ʽ�ļ���

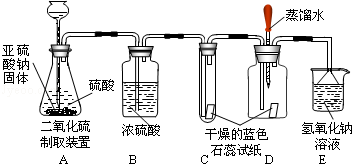
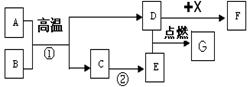
��7�֣����ϱ������ڲ�ͬ�¶��£�CO�ɽ�Fe2O3��ԭΪFe��Fe3O4�е�һ�ֻ����֡�Ϊ̽���¶ȶԸ÷�Ӧ�����Ӱ�죬��������ʵ�顣
���������ϡ�
��Fe3O4�����ᷴӦ���õ�FeCl2��FeCl3�Ļ����Һ
����������������һ����FeCl2��FeCl3��Һ��������ʵ�飬Ϊ��������ṩ�ο�
| | FeCl2��Һ | FeCl3��Һ |
| ����Fe | �����Ա仯 | ��Һ���dz��ɫ |
| ���Լ�A | �����Ա仯 | ��Һ��ɺ�ɫ |
�ס�������ͬѧ�ֱ��þƾ��ƺ;ƾ������Ϊ��Դ����CO��ԭFe2O3��ʵ�飬����õ��ĺ�ɫ����ijɷ֣�ʵ���¼���¡�
| ʵ����� | ʵ������ | ��������� |
| ��ȡ�����ĺ�ɫ�������Թ��У��μ�������______ ����������õ���Һ�У��μ��Լ�A | ���飺 �����ܽ⣬������ð�� ���Լ�A����Һ��ɺ�ɫ | ��ɫ����ijɷ���______ ������CO��ԭFe2O3��Ӧ�Ļ�ѧ����ʽ��______ |
| ���飺 �����ܽ⣬ ���Լ�A����Һ��ɫ�����Ա仯 | ��ɫ����ijɷ���Fe |
��1����ϴ˴�̽���������Ϊ����˵����ȷ����______������ţ���
a���¶Ȼ�Ӱ�췴Ӧ�IJ���
b���Լ�A���ڼ���FeCl3��Һ
c������CO��ԭFe2O3��ʵ��ʱ��һ��Ҫ����β������
d���õ��ĺ�ɫ���������һ��С�ڲμӷ�Ӧ��Fe2O3������
 ��2��������Ϊ�����ʵ�������Ƿȱ�����Ƿ���ͬ�˹۵㣬�������� ��
��2��������Ϊ�����ʵ�������Ƿȱ�����Ƿ���ͬ�˹۵㣬�������� �� ij��ѧ����Χ�ơ�����кͷ�Ӧ������ѧ���ֳ�����С�飬����ʦ�����¿�չ̽����������ǽ�ѧƬ�Σ��������ѧϰ��������д�ո�(�������пո�)��
����ʾʵ�顿��һ������ϡ������뵽ʢ��NaOH��Һ��С�ձ��С�
��ѧ�����ݡ��÷�Ӧ�Ļ�ѧ����ʽ______________��
��������⡿ʵ����δ�۲쵽����������ͬѧ���������ʣ���Ӧ����Һ��������ʲô��?
��������롿������ʣ���ҷ�������롣����ͬѧ�IJ������£�
����һ��ֻ��Na2SO4
���������Na2SO4��H2SO4
����������Na2SO4��NaOH
�����ģ���Na2SO4��H2SO4��NaOH
����ͬѧ�����ϲ���������ɣ���Ϊ��һ�ֲ����Dz������ġ��������IJ�����
____________________��
��ʵ��̽����(1)����ͬѧȡ�ձ��е���Һ�������Թ��У��μӼ���CuSO4��Һ�������Ա仯����Һ��һ��û��____________��
(2)Ϊ����֤������룬��ѧϰС�������ձ��е���Һ����ѡ����ʦ�ṩ��pH��ֽ��ͭƬ��BaCl2��Һ��Na2CO3��Һ��������������������̽����
| ʵ�鷽�� | ����ҺpH | �μ�Na2CO3��Һ | �μ�BaCl2��Һ |
| ʵ����� |  |  | 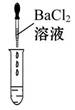 |
| ʵ������ | ��ֽ��ɫ���Աȱ�ɫ����pH<7 | | ������ɫ���� |
| ʵ����� | ��Һ����H2SO4 | ��Һ����H2SO4 | ��Һ����H2SO4 |
���ó����ۡ�ͨ��̽����ȫ��ͬѧһ��ȷ�����������ȷ�ġ�
�����۷�˼����ʦ��ͬѧ�����ö��ַ�������̽�������ҵó���ȷ���۸���϶���ͬʱָ����ʵ��̽����(2)�д����������Դ������ҷ�˼��ͬѧ�Ǿ�����˼����������������
(1)ʵ������еĴ�����____________________��
(2)ʵ�鷽����Ҳ��һ���Ǵ���ģ������ԭ����_____________________��
С÷ͬѧ�ڼ�����������������������������ʱ��������м���һ�ְ�ɫ��ĩ�������ͷۣ���������������ɶ�ף����ܸ���Ȥ��Ū���ף����ͷ�Ϊʲô������������������ɶ���أ�����һͬ����С÷��̽����
��������⡿С÷Ҫ̽������������ ����
���������ϡ����ͷ۵���Ҫ�ɷ���̼�����ƣ��׳�С�մ�������ˮ����������Һ����ʱ���ֽܷ⣬����һ���Ρ�һ�������ˮ��
��ʵ��̽����С÷������ʵ�鷽��̽��С�մ����ȷֽ�IJ��
| ʵ�鲽�� | ʵ������ | ʵ����� |
| 1��ȡ����С�մ�������Թ��м��ȣ��������ɵ�����ͨ�����ʯ��ˮ | ��1���Թܿڴ���Һ������ ��2������ʯ��ˮ����� | ��1�����ɵ�Һ����ˮ ��2�����ɵ��������� ����д��ѧʽ�� |
| 2��ȡ������ּ��Ⱥ��ʣ���������ˮ������ϡ���� | �� �� | ���ɵ�����̼���� |
��ʵ����ۡ�С�մ����ȷֽ�������������������γ�����С���ң�ʹ��������������ɶ�ף���ôС�մ����ȷֽ�Ļ�ѧ����ʽ���� ����
����չ���졿С��������Ϸ��֣���NaHCO3+NaOH=Na2CO3+H2O����������������ˮ��С���NaOH��Һ��NaHCO3��Һ��Ϻ�ȴ�������������������ʣ������������Ƿ����˻�ѧ��Ӧ������ʦ�����£����Ƿֱ�ͨ������2��ʵ��֤��NaOH��Һ��NaHCO3��Һ��ȷ�����˷�Ӧ������1�ͷ���2��ʵ�����û�������
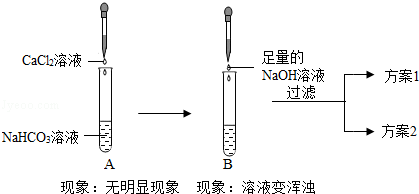
��ʵ��1��֤����Ӧ������Na2CO3��
С����Ϊ��B����Һ����ǣ�����֤����Na2CO3���ɣ�ϸ�ĵ�С÷��Ϊ�ý��۲��ԣ����������� ����С÷������ͼ��ʵ�飬������˷���1��֤����Ӧ��������Na2CO3����ô����1�ǣ�Ҫ��д��ʵ�鲽�衢����ͽ��ۣ��� ����
��ʵ��2����֤����Ӧ��NaHCO3�����ڣ�
С��������ͼ��ʵ�飬������˷���2��֤����Ӧ��NaHCO3�����ڣ���ô����2�ǣ�Ҫ��д��ʵ�鲽�衢����ͽ��ۣ��� ����
���ܽ���ɡ�ͨ��ʵ��1��ʵ��2˵��������û����������Ļ�ѧ��Ӧ�����Դ�������ͬ�Ƕ�֤����Ӧ�ķ������������Ƕ��ǣ�һ���� ���������� ����
ijͬѧ��������ͼ��ʾ��ʵ�飬��14.6%��ϡ�����м���̼��ƣ������10.6%��̼������Һ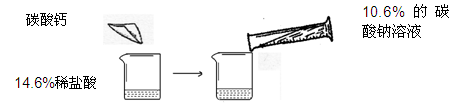
| | ��һ�� | �ڶ��� |
| 14.6%��ϡ��������� | m | m |
| ����̼��Ƶ����� | 10g | 20g |
| ����10.6%��̼������Һ������ | 100g | 200g |
| ����̼������Һ��ʵ������ | ֻ������ | ֻ�а�ɫ���� |
д��ʵ��һ�з�����ѧ��Ӧ�ķ���ʽ
��һ��ʵ���м���̼��ƺ���Һ�����ʳɷ�
������֪�����г����ڶ���ʵ�����ɳ����������ı���ʽ
ʵ���м���ϡ����m������Ϊ
�����ڶ��η�Ӧ�����Һ����191.2gˮ�������ò�������Һ�����ʵ���������Ϊ
����������������29.2%��Ũ��������ʵ�������ϡ���ᣬ����Ҫ��ˮ������
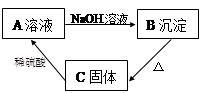
 B_____________________��
B_____________________��