题目内容
【题目】同学们运用对比的学习方法探究碱的性质。
实验一 | 实验二 |
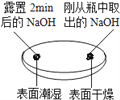
观察固体表面
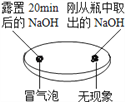
| 向两块固体表面滴加稀盐酸
|
(1)由上图实验一、二可知,氢氧化钠会吸收空气的_________,因此要密封保存。
(2)同学们看到盛有NaOH的试剂瓶上标注着“NaOH含量不少于96.0%”,开始如下探究:
【提出问题】氢氧化钠中含有什么杂质?
【查阅资料】工业制取NaOH的反应原理是:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,然后蒸发溶剂获得NaOH固体(在化工生产中,原料往往不能完全转化为产品)。
2NaOH+H2↑+Cl2↑,然后蒸发溶剂获得NaOH固体(在化工生产中,原料往往不能完全转化为产品)。
【提出猜想】杂质为_________和NaCl。理由是氢氧化钠暴露在空气中变质和氯化钠没有完全转化为氢氧化钠。
【实验探究】取样溶于水,并分成两份。
实验步骤 | 实验现象 | 实验结论 |
步骤①:向一份溶液中滴加酚酞试剂 | 溶液变红 | 猜想正确 |
步骤②:向另一份溶液中滴加过量___________ | 产生气泡 | |
步骤③:向步骤②所得溶液中滴加___________溶液 | 产生白色沉淀 |
【实验反思】
Ⅰ.上述实验中步骤 ___(填写序号)是没有必要进行的;
Ⅱ.步骤②所得溶液中的溶质除NaCl外,还有____________。
【答案】 水和二氧化碳 Na2CO3 稀HNO3 AgNO3 ① NaNO3和HNO3
【解析】由题中信息知,(1)由上图实验一、二可知,氢氧化钠会吸收空气的水和二氧化碳 ,因此要密封保存。(2)【提出问题】氢氧化钠中含有什么杂质?【查阅资料】工业制取NaOH的反应原理是:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,然后蒸发溶剂获得NaOH固体(在化工生产中,原料往往不能完全转化为产品)。【提出猜想】杂质为Na2CO3 和NaCl。理由是氢氧化钠暴露在空气中变质和氯化钠没有完全转化为氢氧化钠。【实验探究】取样溶于水,并分成两份。
2NaOH+H2↑+Cl2↑,然后蒸发溶剂获得NaOH固体(在化工生产中,原料往往不能完全转化为产品)。【提出猜想】杂质为Na2CO3 和NaCl。理由是氢氧化钠暴露在空气中变质和氯化钠没有完全转化为氢氧化钠。【实验探究】取样溶于水,并分成两份。
实验步骤 | 实验现象 | 实验结论 |
步骤①:向一份溶液中滴加酚酞试剂 | 溶液变红 | 猜想正确 |
步骤②:向另一份溶液中滴加过量稀HNO3 | 产生气泡 | |
步骤③:向步骤②所得溶液中滴加AgNO3溶液 | 产生白色沉淀 |
【实验反思】Ⅰ.上述实验中步骤①是没有必要进行的;Ⅱ.步骤②所得溶液中的溶质除NaCl外,还有NaNO3和HNO3。
点睛∶本题是一道实验探究题,主要考查运用对比的学习方法探究碱的性质。