题目内容
【题目】如图为电解水的装置。通电前,为增加导电性加入了少量的硫酸钠,再加入酚酞溶液,溶液呈无色。
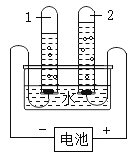
(1)通电一段时间后,试管 1 中的水溶液呈红色,说明试管 1 中的溶液PH_____ 7(填“大于”“小于”或“等于”);试管 1 中的气体是 _____。
(2)电解水的化学方程式为_____ 。
(3)检验正极产生的气体的方法是_____。
(4)氢气作为新能源,其主要优点是_____。
【答案】大于 H2 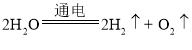 把带火星的木条伸入试管中,木条复燃,则是氧气 燃烧的产物只有水,清洁无污染
把带火星的木条伸入试管中,木条复燃,则是氧气 燃烧的产物只有水,清洁无污染
【解析】
(1)酚酞溶液遇碱性溶液变红,遇中性或酸性溶液不变色。通电一段时间后,试管 1 中的水溶液呈红色,说明试管 1 中的溶液pH大于7;电解水时,正极产生氧气,负极产生氢气,氢气体积是氧气体积的2倍,试管 1 中的气体是氢气;
(2)电解水的原理是水在通电条件下分解生成氢气和氧气,化学方程式为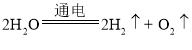 ;
;
(3)检验正极产生的气体的方法是把带火星的木条伸入试管中,木条复燃,则证明是氧气;
(4)氢气作为新能源,其主要优点是燃烧的产物只有水,清洁无污染,热值高。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案【题目】同学们对一包干燥的红色粉末氧化铁的含量进行测定。请你参与并回答有关问题。称取该粉末5.0g装入硬质玻璃管中,按下图在通风橱中进行实验。开始时缓缓通入CO气体,过一段时间后再加热使其充分反应。待反应完全后,停止加热,继续通CO气体至玻璃管冷却。反应前后称量相关装置和物质的总质量,其数据如下表(假定粉末中的杂质不参加反应,也不发生变化):
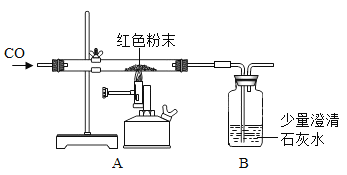
反应前 | 反应后 | |
①组 | 玻璃管和红色粉末的总质量为37.5g | 玻璃管和固体物质的总质量为36.3g |
②组 | 洗气瓶和所盛溶液的总质量为180.0g | 洗气瓶和瓶中物质的总质量为180.1g |
(交流讨论)
(1)开始实验时,在A装置中应_____(选序号“a.先通CO,排尽空气”“b.先加热红色粉末”)。
(2)选择①组的实验数据计算来确定红色粉末中氧化铁的质量分数是_____%,造成②组洗气瓶和瓶中物质的总质量增加量过小的原因是(写一点)_____。
(3)实验中观察到A装置反应管中的现象为_____。
(4)为了防止溶液倒吸,本实验停止加热前_____(填“需要”或“不需要”)先断开A和B的连接处。本实验中,为达到测定氧化铁含量的目的,可以用_____代替CO气体。
(反思评价)从环保角度看,该实验装置设计上不足之处是_____。
【题目】化学兴趣小组的同学发现实验台上一瓶标签破损的无色溶液(标签如下图)。
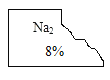
[猜想与假设]
小宁:可能是氢氧化钠溶液;小静:可能是_______溶液;小致:可能是Na2SO4溶液。小远同学认为小宁的猜想不可能,原因是_________。
[实验探究]
实验操作 | 实验现象 | 结论 |
取该溶液少许,滴加_______ | 有气泡产生 | ________同学的猜想成立 |
[反思与评价]标签为什么会破损,小静同学想测定该溶液的酸碱度,她的操作步骤是:________。 测得溶液的pH_______(填“>”“<”或“=”)7,溶液显_______(填“酸”“碱”或“中”)性,倾倒液体时标签未向着手心,致使溶液腐蚀标签,标签破损。
【题目】复方氢氧化镁片[有效成分Mg(OH)2]和复方碳酸镁片[有效成分MgCO3]是两种常见的抗胃酸药。从A或B中任选一个作答,若均作答,按A计分。
A | B |
(1)Mg(OH)2的相对分子质量为___________。 (2)用复方碳酸镁片治疗胃酸过多症时,反应的化学方程式为_____________。 | (1)MgCO3中氧元素质量分数的计算式为___________。 (2)用复方氢氧化镁片治疗胃酸过多症时,反应的化学方程式为__________。 |
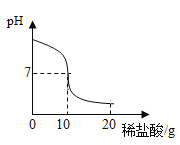
【题目】将20.0g稀盐酸逐滴加入到10.0g溶质质量分数为40%的氢氧化钠溶液中,边滴加边搅拌,随着稀盐酸的滴加,溶液的pH变化情况如图所示,溶液的温度变化如表所示(不考虑反应过程中热量散失)
反应时间(s) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
溶液温度(℃) | 20.5 | 20.6 | 20.7 | 20.8 | 20.9 | 20.8 | 20.7 |
(1)当稀盐酸与氢氧化钠溶液恰好完全反应时,溶液的温度是_____℃
(2)计算稀盐酸中溶质的质量分数_________(精确到0.1%)