题目内容
【题目】化学兴趣小组的同学发现实验台上一瓶标签破损的无色溶液(标签如下图)。
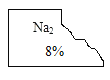
[猜想与假设]
小宁:可能是氢氧化钠溶液;小静:可能是_______溶液;小致:可能是Na2SO4溶液。小远同学认为小宁的猜想不可能,原因是_________。
[实验探究]
实验操作 | 实验现象 | 结论 |
取该溶液少许,滴加_______ | 有气泡产生 | ________同学的猜想成立 |
[反思与评价]标签为什么会破损,小静同学想测定该溶液的酸碱度,她的操作步骤是:________。 测得溶液的pH_______(填“>”“<”或“=”)7,溶液显_______(填“酸”“碱”或“中”)性,倾倒液体时标签未向着手心,致使溶液腐蚀标签,标签破损。
【答案】Na2CO3 因为氢氧化钠化学式中Na右下方没有2 稀盐酸 小静 在玻璃片上放一片pH试纸,用玻璃棒蘸取待测液滴到pH试纸上,立即与标准纸比色卡比较,读出溶液的pH值 > 碱性
【解析】
[猜想与假设]
根据Na元素的化合价为+1,其形成的化学式中个数为2个,可推测其结合的阴离子化合价-2,可为SO42-、CO32-所以可结合为Na2CO3或Na2SO4;由于在这个标签中Na的右下方为2,而氢氧化钠化学式中Na右下方没有2,所以小宁的猜想不对。
故答案为:Na2CO3;因为氢氧化钠化学式中Na右下方没有2;
[实验探究]
由于反应产生气泡,根据上述物质可分析出为:Na2CO3与稀盐酸反应,故答案为:稀盐酸;小静;
[反思与评价]
测定溶液pH的步聚是:在玻璃片上放一片pH试纸,用玻璃棒蘸取待测液滴到pH试纸上,立即与标准纸比色卡比较,读出溶液的pH值;根据Na2CO3的性质可知,碳酸钠溶液显碱性,pH>7;
故答案为:在玻璃片上放一片pH试纸,用玻璃棒蘸取待测液滴到pH试纸上,立即与标准纸比色卡比较,读出溶液的pH值;>;碱性。

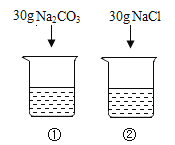
【题目】下表是 Na2CO3、NaCl 的溶解度。依据表中数据和实验回答以下小题。
温度 | Na2CO3 | NaCl |
20℃ | 21.8g | 36.0g |
30℃ | 39.7g | 36.3g |
20℃时,向 2 只盛有 100g 水的烧杯中,分别加入 30g 两种固体,充分溶解。
【1】①中溶液的质量为
A.100g
B.121.8g
C.130g
D.139. g 7
【2】上述溶液为饱和溶液的是
A.①
B.①②
C.②
D.无
【3】下列说法正确的是
A.烧杯①中溶质与溶剂的质量比为 3:10
B.烧杯②中溶质的质量分数为 30%
C.烧杯①中溶液升温至 30℃,溶质质量分数不变
D.烧杯①②中溶液升温至 30℃(忽略水的蒸发),溶液质量①=②
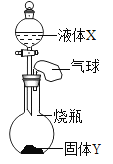
【题目】如图所示,将一定量的液体 X 滴入到烧瓶中,若小气球先鼓起,一段时间后又变瘪(液体 X的体积忽略不计),则液体 X 和固体 Y 是( )
选项 | 液体X | 固体Y |
A | 水 | 氧氧化钠 |
B | 水 | 碳酸铵 |
C | 过氧化氢溶液 | 二氧化锰 |
D | 稀盐酸 | 碳酸钠 |
A.AB.BC.CD.D