题目内容
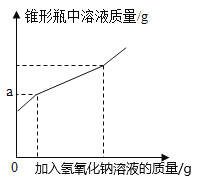
【题目】现有盐酸和铁锈反应后的溶液,为测定溶液中氯化铁的含量,某化学活动小组称取样品溶液50g放入锥形瓶中,再向锥形瓶中滴加氢氧化钠溶液,反应过程中产生沉淀质量的部分实验数据和锥形瓶中溶液质量变化的图象如表所示:
加入氢氧化钠溶液的质量/g | 70 | 90 | 120 | 140 |
产生沉淀的质量/g | 2.14 | 3.21 | 4.28 | m |
(1)表中m的值是 ;
(2)50克样品中氯化铁的质量分数是 ;
(3)求该实验中所用氢氧化钠溶液的溶质质量分数。(写出计算过程)
(4)如图图象中a的数值是 。
【答案】(1)4.28(2)13%(详见解析)(3)6%(4)80
【解析】
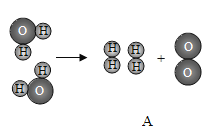
氯化铁和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,化学方程式为:![]() 。
。
(1)根据表中数据分析,加入70g氢氧化钠溶液时,产生2.14g沉淀,加入90g氢氧化钠溶液时,产生3.21g沉淀,说明加入20g氢氧化钠溶液,就能产生1.07g沉淀,那么加入120g氢氧化钠溶液时,又多加了30g氢氧化钠溶液,如果完全反应,可以产生1.605g沉淀,则沉淀总质量为1.605g+3.21g=4.815g,但实际上总沉淀的质量是4.28g,说明氯化铁已经反应完全,再加入氢氧化钠溶液不会产生沉淀,所以m=4.28;
(2)根据(1)可知,最终生成的氢氧化铁沉淀是4.28g,设氯化铁的质量为x。
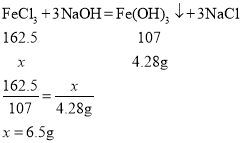
则50克样品中氯化铁的质量分数![]() ;
;
(3)根据(1)可知,每加入20g氢氧化钠溶液,就能产生1.07g氢氧化铁沉淀,设20g氢氧化钠溶液中的溶质质量为y。
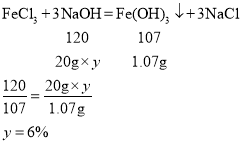
则氢氧化钠溶液的溶质质量分数为6%;
(4)根据图像分析,当刚开始加入氢氧化钠溶液时,氢氧化钠先和溶液中的盐酸反应生成氯化钠和水,此过程增加的质量就是氢氧化钠溶液的质量,反应完全后,氢氧化钠继续和氯化铁反应生成氢氧化铁沉淀和氯化钠。根据(1)可知,加入20g氢氧化钠溶液,就能产生1.07g氢氧化铁沉淀,所以当加入70g氢氧化钠溶液时,产生的沉淀是2.14g,则产生沉淀消耗的氢氧化钠溶液质量为40g,那么与盐酸反应的氢氧化钠溶液的质量=70g-40g=30g,所以由起始到a点溶液增加的质量是30g,溶液起始质量为50g,则a=80。

 初中暑期衔接系列答案
初中暑期衔接系列答案