题目内容
【题目】硫酸是化工生产中重要的酸,其产量最大,用途最广,消耗量最多。历史上曾将硫酸的产量或消耗量作为一个国家化工生产发达程度的标志。
浓硫酸具有吸水性、脱水性和强氧化性。浓硫酸的腐蚀性主要是由它的脱水性和强氧化性引起的。稀硫酸有强酸性,稀硫酸的腐蚀性则主要是由酸性及水分蒸发后变浓而产生的。
硫酸的用途极广,常用于生产化肥、冶炼金属、农药、制药等。
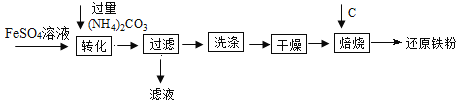
工业制硫酸的流程为: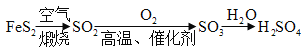
(1)综合分析以上材料,并结合已有知识,请回答:
①工业制H2SO4可能会引起的环境问题是 。
②在实验室中不慎将浓硫酸沾到皮肤上的处理方法是
A 立即用大量水冲洗,然后再涂上3%~5%的碳酸氢钠溶液
B 立即用稀氢氧化钠溶液冲洗,然后再用水冲洗
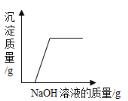
(2)某工厂化验室用9.8%的稀硫酸洗涤一定量化工产品中残留Ba(OH)2,当消耗稀硫酸100g时,反应为:H2SO4+ Ba(OH)2=BaSO4↓+2H2O,沉淀不再产生时(此时恰好完全反应),求反应中Ba(OH)2的质量。
【答案】(1)①形成酸雨(或造成空气污染);②A;(2)17.1g
【解析】
(1)①根据工业制硫酸的流程为:![]() ,因为其中有二氧化硫气体生成,则可推测工业制硫酸可能会引起的环境问题为形成酸雨(或造成空气污染);
,因为其中有二氧化硫气体生成,则可推测工业制硫酸可能会引起的环境问题为形成酸雨(或造成空气污染);
②因为浓硫酸的腐蚀性主要是由它的脱水性和强氧化性引起的,而碳酸氢钠溶液显碱性,故在实验室中不慎将浓硫酸沾到皮肤上的紧急处理方法为立即用大量水冲洗,然后再涂上3%-5%的碳酸氢钠溶液中和残余硫酸,不能使用氢氧化钠,因为氢氧化钠具有强腐蚀性;
故填:A。
(2)设化工产品中残留Ba(OH)2的质量为x,则
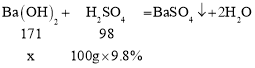
![]()
x=17.1g;
答:化工产品中残留Ba(OH)2的质量为17.1g。

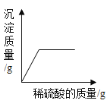
【题目】现有盐酸和铁锈反应后的溶液,为测定溶液中氯化铁的含量,某化学活动小组称取样品溶液50g放入锥形瓶中,再向锥形瓶中滴加氢氧化钠溶液,反应过程中产生沉淀质量的部分实验数据和锥形瓶中溶液质量变化的图象如表所示:
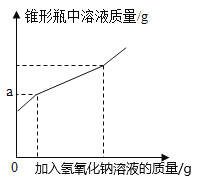
加入氢氧化钠溶液的质量/g | 70 | 90 | 120 | 140 |
产生沉淀的质量/g | 2.14 | 3.21 | 4.28 | m |
(1)表中m的值是 ;
(2)50克样品中氯化铁的质量分数是 ;
(3)求该实验中所用氢氧化钠溶液的溶质质量分数。(写出计算过程)
(4)如图图象中a的数值是 。