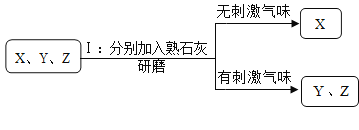
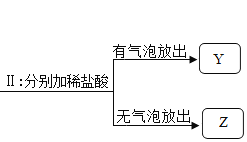
题目内容
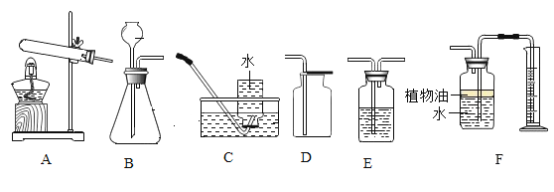
【题目】Ⅰ、下列有关实验操作的描述正确的是______。
A测稀硫酸的pH时,用玻璃棒蘸取溶液滴到湿润的pH试纸上,把试纸显示的颜色与标准比色卡对照
B用CO还原氧化铜时,应先通入CO,后用酒精灯给硬质玻璃管加热
C称量氢氧化钠固体时,应将氢氧化钠固体放在小烧杯中然后放在天平的右盘上称量
D配制50g质量分数为6%的NaCl溶液,在量取液体体积时俯视读数
E蒸发氯化钠溶液结晶时,要把溶液蒸干后再停止加热
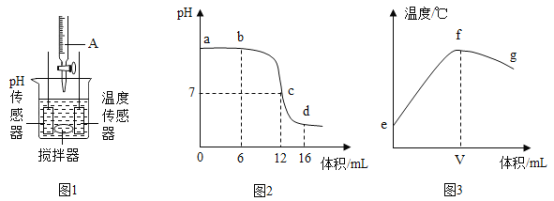
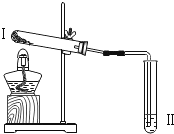
II、水是一种重要的资源,爱护水资源,人人有责。用如图所示装置进行电解水的实验
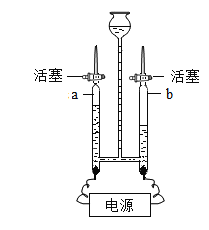
(1)该实验中a、b两玻璃管中收集到的气体质量比为_____,
(2)该实验证明水是由_______组成的;
(3)饮用硬度过大的水不利于人体键康,在生活中可用_________区分硬水和软水。
【答案】B 8:1 氢元素和氧元素 肥皂水
【解析】
Ⅰ、A、将pH试纸用蒸馏水润湿后使用的,会把溶液给稀释了,故测出结果不准确,故选项错误;
B、利用CO还原氧化铜时,先通CO,排尽装置内的空气,再点燃酒精灯,以防止发生爆炸,故选项正确;
C、称量NaOH固体时,不能将NaOH直接放在托盘上的纸上,因为氢氧化钠具有强腐蚀性、容易潮解变质,应该放在烧杯中快速称量,还应按照“左物右码”进行称量,所以装有氢氧化钠的小烧杯应放置在左盘上,故选项错误;
D、配制50g质量分数为6%的NaCl溶液,在量取液体体积时,量筒必须放置在水平桌面上,读数时视线与量筒内凹液面的最底处保持水平,故选项错误;
E、蒸发过程中,待蒸发皿中出现较多量晶体时,停止加热,利用余热使滤液蒸干,故选项错误。故选B。
II、(1)电解水时,正极产生的是氧气,负极产生的是氢气,氧气和氢气的体积比约为1:2,质量比是8:1,根据图示玻璃管a中收集到的气体是氧气,b中收集到的气体是氢气,质量比是8:1;
(2)通过实验可知,电解水生成氢气和氧气,根据质量守恒定律,可以得出水是由氢元素、氧元素组成的;
(3)在生活中可用肥皂水区分硬水和软水,向水中加入肥皂水时,如果产生的泡沫较多,是软水,如果产生大量浮渣,是硬水;

 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案【题目】碳酸钠和碳酸氢钠是生活中常见的盐,通过实验验证、探究它们的化学性质.
(查阅资料)
①![]() ②
②![]()
③Ca(HCO3)2 易溶于水.
④CaCl2 溶液分别与 NaHCO3、Na2CO3 溶液等体积混合现象(表中的百分数为溶液中溶质的质量分数):
NaHCO3 | Na2CO3 | ||||
0.1% | 1% | 5% | 0.1% | ||
CaCl2 | 0.1% | 无明显现象 | 有浑浊 | 有浑浊 | 有浑浊 |
1% | 无明显现象 | 有浑浊 | 有浑浊,有微小气泡 | 有沉淀 | |
5% | 无明显现象 | 有浑浊 | 有浑浊,有大量气泡 | 有沉淀 | |
(进行实验)
序号 | 实验装置 | 主要实验步骤 | 实验现象 |
实验 1 |
| 向 2 支试管中分别加入少量 Na2CO3 和 NaHCO3溶液,再分别滴加盐酸 | 2 支试管中均有气泡产生 |
实验 2 |
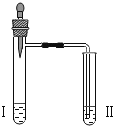
| 向Ⅱ中加入试剂 a,向Ⅰ中加入少量Na2CO3或 NaHCO3固体,分别加热一段时间 | Na2CO3 受热时Ⅱ中无明显现象; NaHCO3 受热时Ⅱ中出现浑浊 |
实验 3 |
| 向Ⅱ中加入试剂 a,向Ⅰ中加入少量 5%的 NaHCO3溶液,再滴加 5%的 CaCl2溶液 | Ⅰ中出现_______; Ⅱ中出现_____。 |
(解释与结论)
(1)实验1中,NaHCO3与盐酸反应的化学方程式为:_________.
(2)实验2中,试剂a为__________.
(3)实验3中,NaHCO3与CaCl2反应的化学方程式为_______ .
(反思与评价)
(1)实验2中,加热NaHCO3后,试管Ⅰ中残留固体成分可能为____(写出所有可能).
(2)资料④中,NaHCO3溶液与CaCl2溶液混合的现象中,有些只观察到浑浊、未观察到气泡,原因可能是_____.
(3)请写出1种鉴别Na2CO3和NaHCO3固体的方法:_____