题目内容
【题目】元素的化学性质与其原子结构有着密切关系
(1)已知钙原子的结构示意图为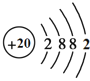 ,则钙元素位于第_______周期。
,则钙元素位于第_______周期。
(2)钙原子和镁原子的化学性质相似,其原因是________
(3)已知偏硅酸的化学式为H2SiO3,则偏硅酸钙的化学式为______________
【答案】四 原子的最外层电子数均为2 CaSiO3
【解析】
(1)根据钙原子的结构示意图,其电子层数为4,原子的电子层数则为元素的周期数,则钙元素位于第四周期。
(2)钙原子和镁原子的化学性质相似,其原因是原子的最外层电子数均为2。
(3)已知偏硅酸的化学式为H2SiO3,氢元素为+1价,则偏硅酸根离子为-2价,由于钙元素显+2价,则偏硅酸钙的化学式为CaSiO3

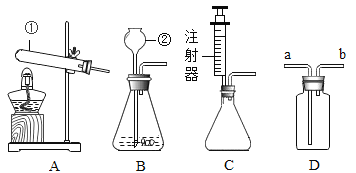
【题目】碳酸钠和碳酸氢钠是生活中常见的盐,通过实验验证、探究它们的化学性质.
(查阅资料)
①![]() ②
②![]()
③Ca(HCO3)2 易溶于水.
④CaCl2 溶液分别与 NaHCO3、Na2CO3 溶液等体积混合现象(表中的百分数为溶液中溶质的质量分数):
NaHCO3 | Na2CO3 | ||||
0.1% | 1% | 5% | 0.1% | ||
CaCl2 | 0.1% | 无明显现象 | 有浑浊 | 有浑浊 | 有浑浊 |
1% | 无明显现象 | 有浑浊 | 有浑浊,有微小气泡 | 有沉淀 | |
5% | 无明显现象 | 有浑浊 | 有浑浊,有大量气泡 | 有沉淀 | |
(进行实验)
序号 | 实验装置 | 主要实验步骤 | 实验现象 |
实验 1 |
| 向 2 支试管中分别加入少量 Na2CO3 和 NaHCO3溶液,再分别滴加盐酸 | 2 支试管中均有气泡产生 |
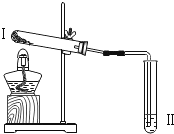
实验 2 |
| 向Ⅱ中加入试剂 a,向Ⅰ中加入少量Na2CO3或 NaHCO3固体,分别加热一段时间 | Na2CO3 受热时Ⅱ中无明显现象; NaHCO3 受热时Ⅱ中出现浑浊 |
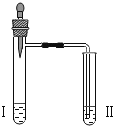
实验 3 |
| 向Ⅱ中加入试剂 a,向Ⅰ中加入少量 5%的 NaHCO3溶液,再滴加 5%的 CaCl2溶液 | Ⅰ中出现_______; Ⅱ中出现_____。 |
(解释与结论)
(1)实验1中,NaHCO3与盐酸反应的化学方程式为:_________.
(2)实验2中,试剂a为__________.
(3)实验3中,NaHCO3与CaCl2反应的化学方程式为_______ .
(反思与评价)
(1)实验2中,加热NaHCO3后,试管Ⅰ中残留固体成分可能为____(写出所有可能).
(2)资料④中,NaHCO3溶液与CaCl2溶液混合的现象中,有些只观察到浑浊、未观察到气泡,原因可能是_____.
(3)请写出1种鉴别Na2CO3和NaHCO3固体的方法:_____