题目内容
【题目】下列实验设计不能达到实验目的的是
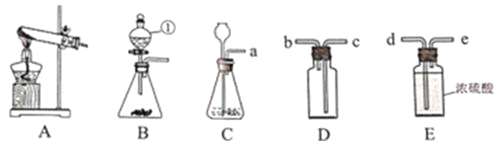
选项 | A | B | C | D |
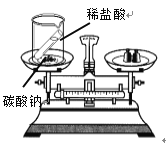
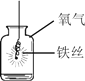
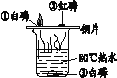
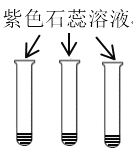
实验 目的 | 验证质量守恒定律 | 验证铁丝能在 氧气中燃烧 | 验证与氧气接触是燃烧的条件之一 | 鉴别NaCl、NaOH和 稀盐酸三种溶液 |
实验 方案 |
|
|
|
|
A. AB. BC. CD. D
【答案】A
【解析】
A、盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,有气体生成,所以验证质量守恒定律时要在密闭容器内,而不是烧杯内,故实验不能成功,不符合题意;
B、铁丝在O2中燃烧时,为防止生成物熔化溅落下来使瓶底炸裂,集气瓶的底部应放少量的水或铺一层细沙,故实验能成功,不符合题意;
C、燃烧的条件是具有可燃物、温度达到该物质的着火点、与氧气接触,铜片上的白磷能够燃烧,红磷不燃烧,红磷没燃烧是因为红磷没有达到着火点,所以得到的燃烧条件是燃烧必须达到可燃物的着火点,铜片上的白磷燃烧,水中的白磷不能燃烧,因为水中没有氧气,所以得到的燃烧条件是燃烧必须与氧气接触,故实验能成功,不符合题意;
D、紫色石蕊溶液遇酸性溶液变红,遇碱性溶液变蓝,NaCl、NaOH和稀盐酸分别显中性、碱性、酸性,使石蕊溶液分别显示紫色、蓝色、红色,能出现三种明显不同的现象,可以鉴别,故实验能成功,不符合题意。故选A。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目