题目内容
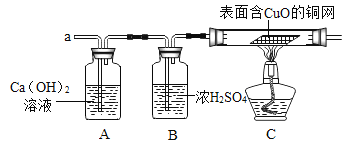
【题目】绿矾(FeSO4·7H2O)、硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]是重要的化工试剂。工业上常利用机械加工行业产生的废铁屑为原料制备绿矾、硫酸亚铁铵(如下图)。

已知:
(1)废铁屑中含有FeS等杂质,FeS+H2SO4=FeSO4+H2S↑,生成的H2S气体有毒。
(2)在0~60℃时,硫酸亚铁铵的溶解度比硫酸铵、硫酸亚铁的小,冷却混合液至室温便析出硫酸亚铁铵。
(3)硫酸亚铁易被氧气氧化为硫酸铁,影响硫酸亚铁铵的等级。
请回答下列问题:
实验一:制备绿矾:
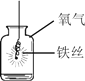
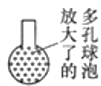
图Ⅰ中仪器①盛放的液体是_____,除了发生的反应FeS+H2SO4=FeSO4+H2S↑外,还发生的另一个反应的化学方程式是_____。广口瓶的作用是_____,烧杯中主要的反应是CuSO4+H2S=CuS↓+H2SO4,硫酸铜溶液的作用是_____;此处烧杯中的导管最好换成多孔球泡,目的是_____。
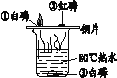
实验二:制备硫酸亚铁铵:
如图Ⅱ。实验步骤如下:
①连接仪器,_____
②制备FeSO4溶液:先关闭止水夹A,再打开止水夹_____,从分液漏斗滴入稀H2SO4至锥形瓶中。其中NaOH溶液中发生反应的化学方程式为_____,此过程中氢气的作用是_____。
③制备硫酸亚铁铵:待锥形瓶中的铁屑快反应完时,关闭止水夹_____,打开止水夹_____,不久会看到锥形瓶中的液体被压入饱和硫酸铵溶液中,放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵晶体。
实验三:对所制得的硫酸亚铁铵样品进行加热
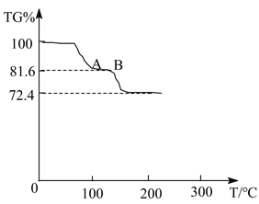
温度与TG%的关系如图所示,已知,200℃以前只有结晶水失去。[Mr(FeSO4·(NH4)2SO4·6H2O)=392],已知:TG%=![]() ×100%。
×100%。
TG%从100%降低为72.4%时,发生反应的化学方程式是_____。试计算AB段物质的化学式_____(写出计算过程)。
【答案】稀硫酸 ![]() 安全瓶(或防倒吸) 尾气处理,防止污染大气 增大接触面积,使反应更充分 检查装置的气密性 BC
安全瓶(或防倒吸) 尾气处理,防止污染大气 增大接触面积,使反应更充分 检查装置的气密性 BC ![]() 排出装置和硫酸铵溶液中的氧气 BC A
排出装置和硫酸铵溶液中的氧气 BC A ![]() FeSO4·(NH4)2SO4·2H2O
FeSO4·(NH4)2SO4·2H2O
【解析】
实验一:工业制备绿矾常用废铁屑和硫酸反应进行制取,故图Ⅰ中仪器①盛放的液体是稀硫酸;废铁屑中一定含有铁,铁和硫酸反应生成硫酸亚铁和氢气,![]() ;广口瓶作为安全瓶收集产生的硫化氢气体和氢气;烧杯中的硫酸铜溶液主要是吸收尾气H2S,防止污染大气;烧杯中的导管最好换成多孔球泡,目的是增大气体与溶液的接触面积,使反应充分进行;
;广口瓶作为安全瓶收集产生的硫化氢气体和氢气;烧杯中的硫酸铜溶液主要是吸收尾气H2S,防止污染大气;烧杯中的导管最好换成多孔球泡,目的是增大气体与溶液的接触面积,使反应充分进行;
实验二:①仪器连接好,一般都要检查装置的气密性,尤其是有气体参加或者生成的反应;
②制备FeSO4溶液先关闭止水夹A,再打开止水夹BC,是为了用产生的氢气将装置内的空气排出,因为亚铁盐容易被氧化;
废铁屑中含有FeS等杂质,硫化亚铁会与硫酸反应生成硫酸亚铁和硫化氢气体,氢氧化钠溶液就是为了吸收硫化氢气体,方程式为:![]() ;此过程中氢气的作用是排出装置和硫酸铵溶液中的氧气,因为亚铁盐容易被氧化;
;此过程中氢气的作用是排出装置和硫酸铵溶液中的氧气,因为亚铁盐容易被氧化;
③制备硫酸亚铁铵:待锥形瓶中的铁屑快反应完时,关闭止水夹BC,打开止水夹A,产生的氢气使锥形瓶中压强增大,将硫酸亚铁压入左边的瓶中,使之反应;
实验三:通过分析可知,对硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]样品进行加热到100℃时,首先是固体表面的分子水蒸发得到硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O],这一步是物理变化,继续加热到100-200℃时,已知200℃以前只有结晶水失去,因此硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]中的结晶水开始脱去,这一步是化学变化.
所以TG%从100%降低为72.4%时,发生反应的化学方程式是:![]() ;
;
假设硫酸亚铁铵晶体质量是392克,AB段物质的化学式为FeSO4·(NH4)2SO4·xH2O;
加热到200℃时,失去结晶水,剩下的硫酸亚铁铵质量为:![]() ;
;
由关系图可知AB段的TG%=81.6%,即![]() ,m水=35.872g,则
,m水=35.872g,则![]() ,所以AB段物质的化学式为FeSO4·(NH4)2SO4·2H2O。
,所以AB段物质的化学式为FeSO4·(NH4)2SO4·2H2O。

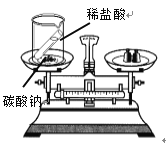
【题目】下列实验设计不能达到实验目的的是
选项 | A | B | C | D |
实验 目的 | 验证质量守恒定律 | 验证铁丝能在 氧气中燃烧 | 验证与氧气接触是燃烧的条件之一 | 鉴别NaCl、NaOH和 稀盐酸三种溶液 |
实验 方案 |
|
|
|
|
A. AB. BC. CD. D