题目内容
【题目】工业上制造高纯度CaO的主要流程示意图如下:
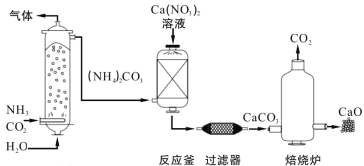
(1)NH3和(NH4)2CO3中氮元素的化合价_______(填“相同”或“不同”)。
(2)反应釜中发生的反应属于复分解反应,其化学方程式是_______。
(3)焙烧炉中,CaCO3在1000℃可分解得到高纯度CaO。理论上5tCaCO3制出CaO的质量是____t。稍冷后,取出CaO立即放入干燥器,其原因是_______(用化学方程式表示)。
(4)上述流程中可以循环使用的物质有_______
【答案】相同 (NH4)2CO3+Ca(NO3)2==CaCO3↓+2NH4NO3 2.8 H2O+CaO==Ca(OH)2 CO2
【解析】
(1)NH3中氢元素显+1价,设氮元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×3+x=0,则x=-3价。(NH4)2CO3中碳酸根显-2价,NH4+中氢元素显+1价,同理可得,氮元素的化合价为-3价,故NH3和(NH4)2CO3中氮元素的化合价相同。
(2)应釜中硝酸钙与碳酸铵反应生成硝酸铵和碳酸钙,属于复分解反应,其化学方程式是Ca(NO3)2+(NH4)2CO3═2NH4NO3+CaCO3↓;
(3)解:设制出CaO 的质量是x,

![]()
解得:x=2.8t
答:制出CaO 的质量是2.8t。
冷后,取出 CaO 立即放入干燥器,防止氧化钙与空气中的水蒸气反应生成氢氧化钙,化学方程式为:H2O+CaO==Ca(OH)2。
(4)该流程中可循环利用的物质是CO2。

 智能训练练测考系列答案
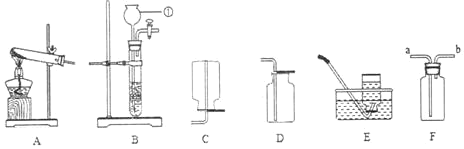
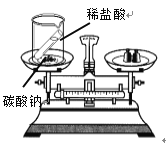
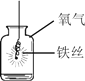
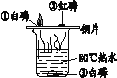
智能训练练测考系列答案【题目】下列实验设计不能达到实验目的的是
选项 | A | B | C | D |
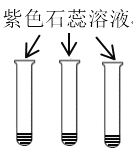
实验 目的 | 验证质量守恒定律 | 验证铁丝能在 氧气中燃烧 | 验证与氧气接触是燃烧的条件之一 | 鉴别NaCl、NaOH和 稀盐酸三种溶液 |
实验 方案 |
|
|
|
|
A. AB. BC. CD. D