题目内容
【题目】向AgNO3、Cu(NO3)2、 Mg(NO3)2 的混合溶液中,加入一定量的铁粉,充分反应后过滤,滤液呈蓝色。下列判断正确的是( )
A.滤液中一定有Fe (NO3)2、 Mg (NO3)2和Cu (NO3)2
B.向滤渣中加入稀盐酸,可能有气泡产生
C.与原溶液相比,滤液的质量可能增大
D.向滤液中滴入稀盐酸,可能会有白色沉淀出现
【答案】AD
【解析】
由于镁、铁、铜、银的金属活动性顺序是镁>铁>铜>银,把一定量的铁放到AgNO3、Cu(NO3)2、Mg(NO3)2 的混合溶液中,铁首先和AgNO3反应,再和Cu(NO3)2反应,而不能与Mg(NO3)2反应,充分反应后过滤,滤液呈蓝色,说明Cu(NO3)2没有全部参与反应,即滤渣中不可能有铁,一定有最不活泼的金属银,可能有铜,铁和硝酸银反应生成银的同时也生成了硝酸亚铁,因此在滤液中一定有Cu(NO3)2、Mg(NO3)2,还有生成的Fe(NO3)2,可能还有剩余的AgNO3。
A、由分析可知,滤液中一定有 Fe(NO3)2、Mg(NO3)2和 Cu(NO3)2,故正确;
B、由分析可知,滤渣中不可能有铁,一定有最不活泼的金属银,可能有铜,所以向滤渣中加入稀盐酸,不可能有气泡产生,故错误;
C、
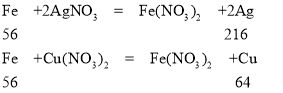
由化学方程式可知,铁与硝酸银、硝酸铜反应都会使溶液的质量减小,故错误;
D、由分析可知,滤液中一定有Cu(NO3)2、Mg(NO3)2,还有生成的Fe(NO3)2,可能还有剩余的AgNO3,向滤液中滴入稀盐酸,可能会有氯化银白色沉淀出现,故正确。
故选:AD。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
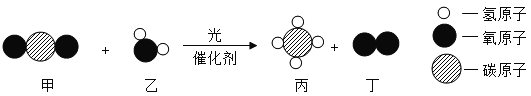
初中学业考试导与练系列答案【题目】在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化见下表。下列说法错误的是( )
物质 | 甲 | 乙 | 丙 | 丁 |
反应前物质的质量(g) | 8 | 32 | 5 | 4 |
反应后物质的质量(g) | 16 | X | 5 | 24 |
A. 该反应为分解反应
B. 丙可能是该反应的催化剂
C. 甲、丁两物质反应前后质量变化之比为2:5
D. X值为28