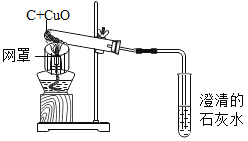
题目内容
【题目】我省有漫长的海岸线,蕴藏着丰富的海洋资源
(1)海水晒盐:
①海水“晒盐”是利用__________(填字母代号)的方法使NaCl晶体析出。
A升高温度,使NaCl溶解度增大
B风吹日晒,使溶剂蒸发
②海水“晒盐”后,所得的母液是氯化钠的________溶液(填“饱和”或“不饱和”)。
(2)粗盐提纯:除去难溶性杂质后的食盐水中还含有Ca2+、Mg2+、SO42-等杂质离子,为得到较纯的氯化钠,进行如下的实验操作:①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④加入适量的盐酸调节溶液的pH等于7 ⑤过滤 ⑥蒸发。下列操作顺序正确的是______(填字母)。
A①③②④⑤⑥
B②③①④⑤⑥
C③①②⑤④⑥
D②③①⑤④⑥
其中操作①加入过量的Na2CO3溶液,可除去的溶液中的离子是______(填离子符号),④加入适量的盐酸调节溶液的pH等于7的目的是__________。
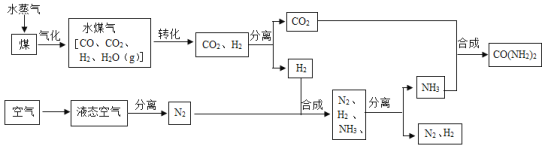
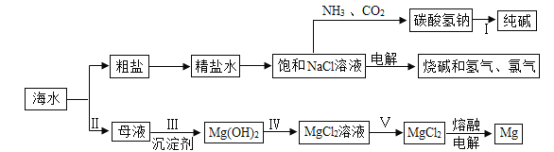
(3)海水制镁:实际生产中,步骤Ⅲ常选用__________(填化学式)作为沉淀剂,写出该反应的化学方程式__________________,从海水中提取MgCl2历经步骤Ⅲ、IV、V三步转换的主要目的是______________。
(4)海水“制碱”:氨碱工业生产过程中,在加压并不断向饱和的氨盐水中通入二氧化碳气体,_______(填化学式)先结晶析出,原因是______________,写出步骤I的化学方程式________________。
【答案】B 饱和 D Ca2+、Ba2+ 除去溶液中的过量的碳酸钠和氢氧化钠 Ca(OH)2 ![]() 使氯化镁富集起来,提纯氯化镁 NaHCO3 在相同条件下碳酸氢钠的溶解度比氯化铵的溶解度小很多
使氯化镁富集起来,提纯氯化镁 NaHCO3 在相同条件下碳酸氢钠的溶解度比氯化铵的溶解度小很多 ![]()
【解析】
(1)①氯化钠的溶解度受温度影响较小,海水“晒盐”是利用蒸发结晶的方法,将高浓度的海水风吹日晒,使溶剂蒸发,得到粗盐;
②海水“晒盐”后,有粗盐析出,所得的母液是氯化钠的饱和溶液。
(2)粗盐提纯:除去难溶性杂质后的食盐水中还含有Ca2+、Mg2+、SO42-等杂质离子,为得到较纯的氯化钠,进行如下的实验操作,操作顺序正确的是: ②加入过量的BaCl2溶液(除去硫酸根离子),③加入过量的NaOH溶液(除去镁离子),①加入过量的Na2CO3溶液(除去钙离子和过量的钡离子),⑤过滤,④加入适量的盐酸调节溶液的pH等于7(除去溶液中的过量的碳酸钠和氢氧化钠),⑥蒸发。
其中操作①加入过量的Na2CO3溶液,可除去的溶液中的离子是钙离子和钡离子(Ca2+ Ba2+ ),④加入适量的盐酸调节溶液的pH等于7的目的是:除去溶液中的过量的碳酸钠和氢氧化钠。
(3)海水制镁:实际生产中,步骤Ⅲ常选用氢氧化钙(Ca(OH)2)作为沉淀剂,氢氧化钙与氯化镁反应产生氯化钙和氢氧化镁沉淀的化学方程式:![]() ,从海水中提取MgCl2历经步骤Ⅲ、IV、V三步转换的主要目的是:使氯化镁富集起来,增大氯化镁的浓度,提纯氯化镁。
,从海水中提取MgCl2历经步骤Ⅲ、IV、V三步转换的主要目的是:使氯化镁富集起来,增大氯化镁的浓度,提纯氯化镁。
(4)海水“制碱”:氨碱工业生产过程中,在加压并不断向饱和的氨盐水中通入二氧化碳气体,碳酸氢铵溶液与氯化钠反应产生碳酸氢钠和氯化铵,碳酸氢钠(NaHCO3)先结晶析出,原因是:在相同条件下碳酸氢钠的溶解度比氯化铵的溶解度小很多,步骤I碳酸氢钠受热分解产生碳酸钠、水和二氧化碳的化学方程式:![]() 。
。

【题目】研究物质的溶解对于生产、生活有着重要意义。
下面表一是硝酸钾的部分溶解度数据。
表一:
温度(°C) | 20 | 40 | 60 | 80 |
溶解度(g/100g水) | 31.6 | 63.9 | 110 | 169 |
(1)由上面表一中数据可知硝酸钾的溶解度随温度升高而______________________(选填“变大”或“变小”)。60℃时硝酸钾饱和溶液中,溶质与溶剂的质量比为________________ (最简整数比) ,能将该饱和溶液转化为不饱和溶液的一种方法是_________________(写出一种即可)
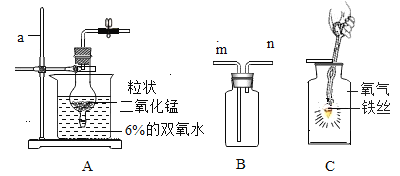
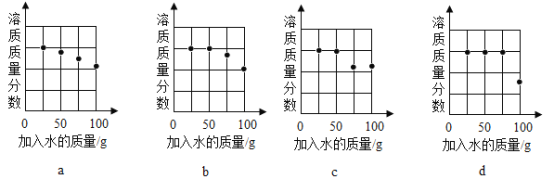
(2)探究20℃时配制硝酸钾溶液过程中,溶质质量分数与加入水的质量关系。
向硝酸钾中分批加水,充分搅拌,现象如下图所示:

下列坐标图中,符合实验结果的描点可能是______________________________ (选填编号) 。
(3)取等质量甲和乙两种物质(均不含结晶水)进行如图所示实验,最终烧杯中析出固体的质量甲小于乙。
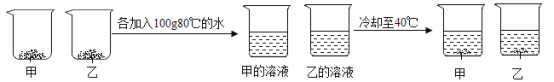
则40℃时,甲的溶解度___________ (选填 “大于”“等于”或“小于”)乙的溶解度,根据本实验结果能否判断40℃~80℃间,甲、乙哪种物质的溶解度变化受温度影响更大___ (选填“能”或“不能”)。
(4)根据表一的数据,20℃时,将50gKNO3固体放入100g 水中充分溶解,所得溶液中溶质的质量分数为________________________; (计算结 果精确到0.1%).
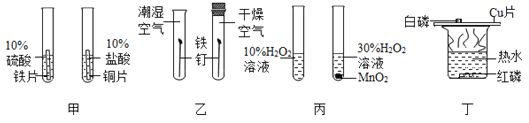
【题目】某化学兴趣小组为探究金属铝和铜的活动性强弱,开展了以下活动。
(查阅资料)经查阅,金属铝在常温下能与空气中的氧气反应生成致密的氧化铝薄膜。氧化铝的化学式为_____。
(对比实验)
编号 | 操作 | 现象 |
甲 | 将表面未打磨的铝丝浸入CuSO4溶液中 | 无明显现象 |
乙 | 将表面打磨后的铝丝浸入CuSO4溶液中 | 铝丝表面析出红色固体 |
丙 | 将表面未打磨的铝丝浸入CuCl2溶液中 | 铝丝表面析出红色固体 |
(1)比较实验乙和实验_____(填“甲”或“丙”)可得知:打磨能破坏氧化铝薄膜。
(2)实验乙中反应的化学方程式为_____,据此可知金属活性Al比Cu_____(填强或弱)。
(3)小明同学对实验丙的现象进行分析,认为H2O对氧化铝薄膜有破坏作用。但此观点马上被其他同学否定,否定的依据是_____。
(猜测与探究)
小组同学针对实验丙的现象,经讨论后猜测:Cl-破坏了氧化铝薄膜。
为检验此猜测是否正确,他们首先向两支试管中加入相同的CuSO4溶液,并均浸入表面未打磨的铝丝,然后进行了新的探究:
操作 | 现象结论 | 推论 | |
(1)向一支试管中再加入NaCl固体 | 铝丝表面析出红色固体 | 氧化铝薄膜被破坏 | Na+或_____能破坏氧化铝薄膜 |
(2)向另一支试管中再加入Na2SO4固体 | _____ | 氧化铝薄膜未被破坏 | Na+和SO42-都不能破坏氧化铝薄膜 |