题目内容
【题目】用如图所示装置(气密性良好)测定空气中氧气的含量,加热粗铜丝- -段时间后,白磷燃烧。下列说法正确的是
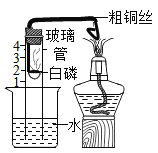
A.白磷燃烧产生大量白色烟雾
B.该实验过程只发生一个化学变化
C.玻璃管中液面从实验开始持续上升至约“刻度1”处
D.氮气不与磷反应且难溶于水是设计该实验的依据之一
【答案】D
【解析】
A、白磷燃烧,产生大量白烟,不是白雾,不符合题意;
B、该实验发生两个化学变化,分别是:白磷和氧气反应生成五氧化二磷,铜在高温下与氧气反应生成氧化铜,不符合题意;
C、白磷燃烧放出大量的热,温度升高玻璃管内压强升高,白磷燃烧消耗氧气,氧气含量减少,压强减少,最后反应完全,冷却后,压强趋于恒定,因此压强的变化是先升高后降低最后不变,因此液面的变化是先降低后上升,最后液面至约“刻度1”处,不是一直持续上升,不符合题意;
D、如果氮气与白磷反应,就不能证明玻璃管内减少的体积就是氧气的体积,而是氮气和氧气的体积之和;如果氮气能溶于水,则玻璃管中的氮气会溶解在水中,导致测得氧气的体积分数偏大,故氮气不与磷反应且难溶于水是设计该实验的依据之一,符合题意。
故选D。

【题目】某化学兴趣小组为探究金属铝和铜的活动性强弱,开展了以下活动。
(查阅资料)经查阅,金属铝在常温下能与空气中的氧气反应生成致密的氧化铝薄膜。氧化铝的化学式为_____。
(对比实验)
编号 | 操作 | 现象 |
甲 | 将表面未打磨的铝丝浸入CuSO4溶液中 | 无明显现象 |
乙 | 将表面打磨后的铝丝浸入CuSO4溶液中 | 铝丝表面析出红色固体 |
丙 | 将表面未打磨的铝丝浸入CuCl2溶液中 | 铝丝表面析出红色固体 |
(1)比较实验乙和实验_____(填“甲”或“丙”)可得知:打磨能破坏氧化铝薄膜。
(2)实验乙中反应的化学方程式为_____,据此可知金属活性Al比Cu_____(填强或弱)。
(3)小明同学对实验丙的现象进行分析,认为H2O对氧化铝薄膜有破坏作用。但此观点马上被其他同学否定,否定的依据是_____。
(猜测与探究)
小组同学针对实验丙的现象,经讨论后猜测:Cl-破坏了氧化铝薄膜。
为检验此猜测是否正确,他们首先向两支试管中加入相同的CuSO4溶液,并均浸入表面未打磨的铝丝,然后进行了新的探究:
操作 | 现象结论 | 推论 | |
(1)向一支试管中再加入NaCl固体 | 铝丝表面析出红色固体 | 氧化铝薄膜被破坏 | Na+或_____能破坏氧化铝薄膜 |
(2)向另一支试管中再加入Na2SO4固体 | _____ | 氧化铝薄膜未被破坏 | Na+和SO42-都不能破坏氧化铝薄膜 |
【题目】二氧化锰在分解过氧化氢溶液反应中的催化原理为:![]() ;
;![]() 。取不同制备方法的二氧化锰与5 mL 10%过氧化氢溶液反应,测得实验数据如下表:
。取不同制备方法的二氧化锰与5 mL 10%过氧化氢溶液反应,测得实验数据如下表:
二氧化锰制备方法 | 高温分解法 | 电解法(市售) | 水热法 |
比表面积/ m2﹒g-1 | 0.468 | 49.3 | 223.274 |
催化剂的质量/mg | 3 | 3 | a |
平均催化速率/mL﹒s-1 | 0.1 | 0.4 | 0.6 |
30 s内产生氧气的体积/mL | 3 | 12 | b |
(1)根据催化原理,你对催化剂的一种新的认识是_____。
(2)根据上表数据分析:a=_____;b=_____。若使催化剂的催化速率最大,要尽可能增大_____。
【题目】同学发现镁与稀盐酸反应的实验中出现灰白色沉淀,该同学对灰白色沉淀的成分进行如下探究:
[提出假设]假设一:含有氯化镁 假设二:含有镁 假设三:含有 氢氧化镁 假设四.....
[查阅资料]①氯化镁易溶于水;②氢氧化镁与稀盐酸反应生成氯化镁和水
[设计并进行实验]
(1)将灰白色沉淀与液体分离的操作名称是_____。
(2)各取少量灰白色沉淀加入2支试管中进行如下实验:
编号 | 实验操作 | 实验现象 | 结论 |
试管1 | _____, | _____ | 假设一不成立 |
试管2 | 加入适量稀盐酸 | 沉淀全部溶解,没有气泡产生 | 假设二_____(填“成立”或“不成立”)假设三可能成立。 |
[实验反思]通过该同学的实验没有获得确切的结论,同学们继续查阅资料,得知该灰白色固体为碱式氯化镁[ Mg(OH)Cl]。
(3)某同学取少量碱式氯化镁加入适量稀盐酸,固体全部溶解且没有气泡产生,得到氯化镁的水溶液。碱式氯化镁与稀盐酸反应的化学方程式为_____。