题目内容
【题目】下列图像不能正确反映的变化关系是
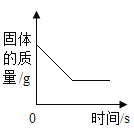
A. 加热高锰酸钾制氧气,随着反应的进行试管内固体的质量变化
B. 往铁粉中逐滴加入硫酸铜溶液,混合物中固体总质量变化
C. 往一定量的石灰石中逐滴加入稀盐酸产生二氧化碳的体积
D. 加热氯酸钾和二氧化锰制取氧气,固体中锰元素质量分数随时间的变化
【答案】B
【解析】
A、加热高锰酸钾制氧气,反应前试管中是高锰酸钾固体,反应不断生成锰酸钾(固体)、二氧化锰(固体)和氧气(气体),根据质量守恒定律可知试管内固体总质量不断减小,反应结束时,试管内固体质量(全部为锰酸钾、二氧化锰)保持不变,故不符合题意;
B、反应前固体质量是铁的质量,铁和硫酸铜反应生成铜和硫酸亚铁,且每56份质量的铁能置换出64份质量的铜,随着反应的进行,铁不断减少铜不断增加,所以混合物中固体总质量增加,反应结束后固体质量为定值,图像应从纵坐标的某点开始增大到定值,故符合题意;
C、石灰石和稀盐酸在常温下就能反应生成二氧化碳气体,随着反应的进行,二氧化碳质量从零开始不断增加,反应结束后二氧化碳质量不变,故不符合题意;
D、加热氯酸钾和二氧化锰制取氧气,反应前二氧化锰的质量分数等于二氧化锰质量和二氧化锰与氯酸钾质量和之比,随着反应的进行,氯酸钾分解生成氯化钾和氧气,试管中固体总质量减少,二氧化锰的质量分数变大,实验结束后,二氧化锰的质量分数达到定值,故不符合题意。

 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案【题目】某化学兴趣小组在探究物质燃烧条件时,做了如下实验:
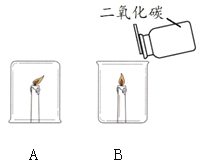
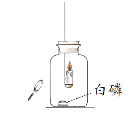
同学们发现两支蜡烛都熄灭了。
(提出问题)实验A中蜡烛熄灭的原因是什么?
(猜想与假设)
猜想1:烧杯内的氧气被耗尽,所以蜡烛熄灭。
猜想2:烧杯内的二氧化碳含量升高,所以蜡烛熄灭。
(进行实验)
实验I:点燃蜡烛,塞紧胶塞。待蜡烛熄灭后,用放大镜照射白磷。观察到白磷燃烧。
实验II:经检测,实验A中,蜡烛熄灭时,烧杯内二氧化碳的体积分数约为3%。在集气瓶中按照一定的体积比收集气体,分别放入燃烧的蜡烛和燃烧的红磷,实验记录如下:
V(O2):V(CO2) | 蜡烛 | 红磷 |
1:4 | 燃烧 | 燃烧 |
1:5 | 燃烧 | 燃烧 |
1:6 | 熄灭 | 燃烧 |
1:9 | 熄灭 | 燃烧 |
(解释与结论)
(1)实验B中蜡烛熄灭,体现二氧化碳的化学性质是_______。
(2)实验I的目的是_______。
(3)写出红磷燃烧的化学方程式_______。
(4)实验II证明猜想2错误,依据的实验现象是_______。
(5)结合实验I与实验II,得出的实验结论是_______。
(实验反思)
(6)通过此实验,同学们对物质燃烧的条件有了新的认识,如_______。