题目内容
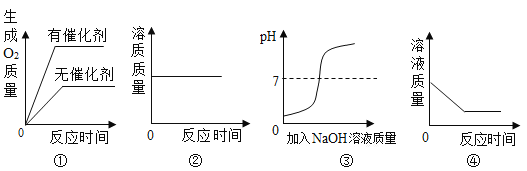
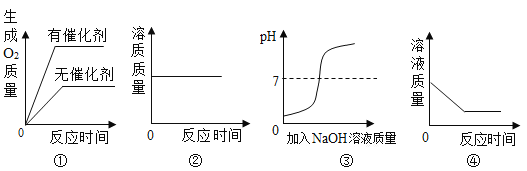
【题目】如图表示稀盐酸和氢氧化钠溶液发生反应过程中溶液的pH的变化,请回答下列问题:
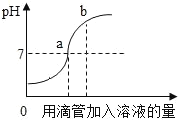
(1)由图可知该实验操作是将_____滴加到另一种溶液中.
(2)所发生中和反应的化学方程式_____.
(3)曲线上b点所含的离子是_____(用符号表示).
(4)下列实际应用中,没有利用中和反应原理的是_____
A 服用含氢氧化铝的药物,可以治疗胃酸过多症
B 用氢氧化钠溶液洗涤石油产品中的残留硫酸
C 用生石灰作干燥剂
【答案】氢氧化钠溶液 NaOH+HCl=NaCl+H2O Na+、Cl﹣、OH﹣ C
【解析】
(1)由图可知起点处pH小于7,随着溶液的加入,溶液的pH由小于7变化为大于7,所以原溶液为稀盐酸,加入的为溶液为氢氧化钠溶液;
(2)反应是盐酸和氢氧化钠反应生成氯化钠和水,对应的化学方程式为![]() ;
;
(3)b点是氢氧化钠过量,所以溶液中有生成的氯化钠和剩余的氢氧化钠,溶液中的离子为![]() 、
、![]() 、
、![]() ;
;
(4)中和反应是酸和碱反应生成盐和水的反应,则有:
A、服用含氢氧化铝的药物,可以治疗胃酸过多症,难溶性碱氢氧化铝和盐酸反应生成氯化铝和水,是中和反应,A选项不正确,不符合题意;
B、用氢氧化钠溶液洗涤石油产品中的残留硫酸,氢氧化钠与硫酸反应生成硫酸钠和水,是中和反应,B选项不正确,不符合题意;
C、用生石灰作干燥剂,是氧化钙和水的反应,生成氢氧化钙,不是中和反应,C选项正确,符合题意。故选C。

【题目】复分解反应的实质就是酸碱盐解离出一些阴、阳离子相互结合生成难解离的水、气体或沉淀,根据下列部分碱盐的溶解性表20℃,回答下列问题:
Na+ | K+ | Ba2+ | |
OH- | 溶 | 溶 | 溶 |
SO42- | 溶 | 溶 | 不 |
CO32- | 溶 | 溶 | 不 |
Cl- | 溶 | 溶 | 溶 |
(1)H2SO4在水中能解离出的离子是_____(填离子符号);
(2)向稀硫酸中滴入氢氧化钡溶液的化学反应方程式为_____,该反应前后溶液中数目发生变化的阴阳离子是_____(填离子符号);
(3)根据溶解性表及复分解反应的实质判断,将“硫酸、氯化钡、氢氧化钠、碳酸钾”四种物质的溶液两两混合,能发生的反应有_____个.
【题目】石灰石的主要成分是碳酸钙。现取80.0g石灰石样品,平均分成四份分别与质量分数相同的盐酸反应来制备二氧化碳气体(杂质不与盐酸反应,也不溶于水),各组的实验数据如下表。
实验分组 | 甲组 | 乙组 | 丙组 | 丁组 |
石灰石样品质量/g | 20.0 | 20.0 | 20.0 | 20.0 |
加入稀盐酸质量/g | 30.0 | 60.0 | 90.0 | 120.0 |
二氧化碳质量/g | 2.2 | m | 6.6 | 6.6 |
通过计算回答:(1)上表格表m= ______g,_____组同学加入的盐酸恰好完全反应;
(2)该种石灰石样品中碳酸钙的质量分数是____?(要求有计算过程);