题目内容
【题目】石灰石的主要成分是碳酸钙。现取80.0g石灰石样品,平均分成四份分别与质量分数相同的盐酸反应来制备二氧化碳气体(杂质不与盐酸反应,也不溶于水),各组的实验数据如下表。
实验分组 | 甲组 | 乙组 | 丙组 | 丁组 |
石灰石样品质量/g | 20.0 | 20.0 | 20.0 | 20.0 |
加入稀盐酸质量/g | 30.0 | 60.0 | 90.0 | 120.0 |
二氧化碳质量/g | 2.2 | m | 6.6 | 6.6 |
通过计算回答:(1)上表格表m= ______g,_____组同学加入的盐酸恰好完全反应;
(2)该种石灰石样品中碳酸钙的质量分数是____?(要求有计算过程);
【答案】4.4 丙 75%
【解析】
(1)由甲、乙、丙三组实验可看出每30g盐酸与足量的碳酸钙反应可生成2.2g二氧化碳,丙组90g盐酸完全反应可生成6.6g二氧化碳,而丁组120g盐酸也生成6.6g二氧化碳,说明丁组的盐酸有剩余,碳酸钙反应完,也就是20g石灰石完全反应生成6.6g二氧化碳,所以丙组恰好完全反应.故答案为:4.4;丙;
(2)设石灰石样品中CaCO3的质量为x.
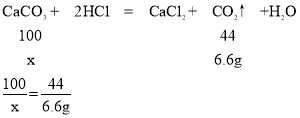
x=15g
所以石灰石样品中碳酸钙的质量=![]() ×100%=75%
×100%=75%
答:石灰石样品中碳酸钙的质量分数为75%.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目