题目内容
【题目】人类生活和工农业生产都离不开水,如图是自来水厂净化水的示意图:
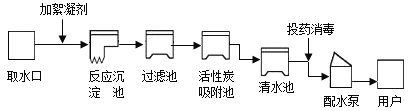
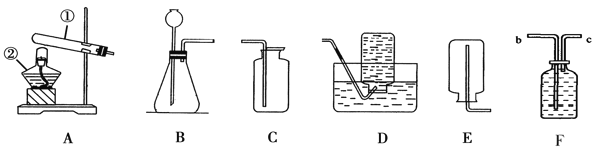
(1)自来水厂生产自来水时.使用的净水方法有____(填选项字母)
A 沉淀
B 过滤
C 煮沸
D 蒸馏
E 吸附
(2)下列行为属于节约用水的是____.(填选项字母)
A 公共场所随手关闭水龙头
B 洗完菜的水用来浇花
C 不间断地放水刷牙
D 农业上为了灌溉更充分通常采用大水漫灌
(3)高铁酸钠(Na2FeO4)是一种新型的净水剂,中铁元素的化合价为______
(4)用工业明胶制成的医用“毒胶囊”中混有的重金属铬对人体有害。这里的铬是指____(填元素"或单质“或原子“)
(5)生活中用____区分硬水和软水,用____方法降低硬度.
【答案】ABE AB +6价 元素 肥皂水 煮沸
【解析】
(1) 自来水厂生产自来水时,使用的净水方法有沉淀、过滤、吸附;
(2) 公共场所随手关闭水龙头头,不会造成水的浪费;洗完菜的水用来浇花,符合节约用水的原则;不间断的放水刷牙,会造成水的浪费;农业上为了灌溉更充分,通常采用大水漫灌,不符合节约用水的原则;
(3) 钠元素显+1价,氧元素显-2价,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×4=0,则x=+6价;
(4) 物质是由元素组成的,这里的“铬”是指元素;
(5) 用肥皂水可以区分硬水和软水,泡沫多的收软水,泡沫少的是硬水;常采取加热煮沸的方法降低硬度。

【题目】通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分得到粗盐.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).
[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[资料准备]
20℃时,一些物质的溶解度 | ||
OH﹣ | CO32﹣ | |
Na+ | 溶 | 溶 |
Ca2+ | 微 | 不 |
Mg2+ | 不 | 微 |
[实验方案]某同学为了提纯粗盐,设计了如下实验方案并进行实验.
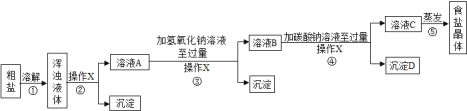
[交流与表达]
(1)实验操作X的名称是__,该操作中要用到的玻璃仪器有烧杯、玻璃棒和__.
(2)实验步骤③的主要目的是__ (用化学方程式回答);
(3)实验步骤④中生成的沉淀D是__.
[反思与评价]
(4)有同学认为原实验方案不完善,为了完善原实验方案,你设计的实验是_______。(写出补充部分的实验操作和现象)