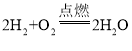题目内容
【题目】同学们在初中化学实验室中,发现一瓶如图所示久置的瓶口有白色固体、瓶塞丢失的无色溶液。已知原溶液可能是NaCl、NaOH或Na2CO3三种溶液中的一种,为确定溶液成分,同学们进行了如下探究:
![]()
(1)探究成分
①小张同学取待测液测得pH=10,他得出的溶液中一定不含_______。他取少量待测液于试管中,加入过量的稀HCl,看到______,由此小张同学认为,溶液为Na2CO3溶液。
②小李同学对小张同学的结论提出疑问,拟进行以下实验:取少量待测液于试管中,加入过量的BaCl2溶液,生成白色沉淀,该反应方程式为_______,过滤,取滤液,(写出还需进行的操作及现象)________________。通过实验,小李认为小张结论不正确。
③同学们通过讨论认为试剂瓶原标签应该是氢氧化钠,但因吸收空气中 _____的而变质。
(2)测定碳酸钠的浓度
取该试剂瓶中溶液50g倒入烧杯中,再向烧杯中逐滴滴加盐酸使其充分反应至无气泡产生(假设生成的二氧化碳全部逸出)。测得加入盐酸的质量与烧杯中的物质的质量关系如下表所示。
累计加入盐酸的质量/g | 0 | 25 | 37.5 | 50 |
烧杯中物质的总质量/g | 50 | 75 | 85.3 | 97.8 |
请你计算:①这一测定过程中产生二氧化碳质量为___g。
②这一瓶试剂中碳酸钠的质量分数___(写出计算过程)。
【答案】氯化钠 气泡产生 ![]() 加入无色酚酞溶液,溶液显红色 二氧化碳 2.2 10.6%(详见解析)
加入无色酚酞溶液,溶液显红色 二氧化碳 2.2 10.6%(详见解析)
【解析】
(1)①取待测液测得pH=10,得出的溶液中一定不含氯化钠,因为氯化钠溶液显中性,取少量待测液于试管中,加入过量的稀HCl,看到有气泡产生,由此认为,溶液为Na2CO3溶液,因为碳酸钠与稀盐酸反应有二氧化碳生成。
②取少量待测液于试管中,加入过量的BaCl2溶液,生成白色沉淀,碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠,该反应方程式为![]() ,过滤,取滤液,加入无色酚酞溶液,溶液显红色,说明溶液中含有氢氧化钠,通过实验,小李认为小张结论不正确。
,过滤,取滤液,加入无色酚酞溶液,溶液显红色,说明溶液中含有氢氧化钠,通过实验,小李认为小张结论不正确。
③同学们通过讨论认为试剂瓶原标签应该是氢氧化钠,但因吸收空气中二氧化碳的而变质,二氧化碳与氢氧化钠反应生成碳酸钠和水。
(2)①加入盐酸的质量在0-25g时,反应前质量=50g+25g=75g,反应后质量仍然是75g,反应前后物质质量不变,期间没有二氧化碳生成,说明是氢氧化钠和稀盐酸反应;反应产生二氧化碳的质量为:50g+50g-97.8g=2.2g;
②设碳酸钠的质量为x,则

![]()
x=5.3g;
因此碳酸钠的质量分数为:![]() 。
。
答:这一瓶试剂中碳酸钠的质量分数为10.6%。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案【题目】甲和乙的溶解度(见下表)及溶解度曲线(如下图)。下列说法不正确的是
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度S/g | 甲 | 26.3 | 28.2 | 31.4 | 31.4 | 30.0 | 28.2 |
乙 | 30.6 | 28.2 | 26.8 | 31.4 | 37.5 | 42.0 | |

A.甲、乙为易溶物质
B.t2值介于20~40℃
C.甲、乙饱和溶液从t3降温到t2,溶质的质量分数都变小
D.等质量的甲,乙饱和溶液从t1升温到t3,为使其溶液恰好饱和,继续添加的甲、乙固体质量相等