题目内容
“黄铜”是铜、锌合金,为了测定某黄铜样品中锌的质量分数,甲、乙、丙三位同学分别进行实验,实验数据如下:(烧杯质量均为56g)
请回答下列问题:
(1) 同学取用的稀盐酸和样品恰好完全反应,他制取的氢气的质量是 。
(2)计算黄铜样品中锌的质量分数。
| | 甲 | 乙 | 丙 |
| 烧杯+稀盐酸质量 | 139g | 129g | 129g |
| 加入黄铜样品质量 | 20g | 24g | 20g |
| 充分反应后,烧杯+剩余物质质量 | 158.8g | 152.8g | 148.8g |
请回答下列问题:
(1) 同学取用的稀盐酸和样品恰好完全反应,他制取的氢气的质量是 。
(2)计算黄铜样品中锌的质量分数。
(1)丙;0.2g;(2)32.5%
试题分析:解:(1)根据质量守恒定律知丙同学的操作恰好完全反应,制取氢气的质量为;129g+20g-148.8g=0.2g;
(2)设黄铜样品中参加反应的锌为X
Zn + 2HCl= ZnCl2 + H2↑
65 2
X 0.2
65:2=X:02g
X=6.5g
黄铜中鋅的质量分数为:
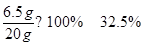
答(1)丙 生成的氢气的质量为0.2g
(2)黄铜中鋅的质量分数为32.5%

练习册系列答案
相关题目

 CaO+ CO2↑
CaO+ CO2↑ 