题目内容
生产烧碱的工厂,常用便宜的原料纯碱和熟石灰制得成品。为模拟该生产过程,同学们取20gNa2CO3溶液与一定质量的饱和石灰水混合,恰好完全反应,得到4g白色沉淀。
求(1) Na2CO3中Na、C、O各元素的质量比 (2分)。
(2) Na2CO3中Na、C、O各原子个数比 (2分)。
(3)Na2CO3溶液中溶质的质量分数。(8分)
求(1) Na2CO3中Na、C、O各元素的质量比 (2分)。
(2) Na2CO3中Na、C、O各原子个数比 (2分)。
(3)Na2CO3溶液中溶质的质量分数。(8分)
(1)23﹕6﹕24 (2)2﹕1﹕3 (3)21.2%
试题分析:首先根据题意正确写出化学方程式并找出其中一纯净物的质量,然后把这一纯净物的质量代入化学方程式计算有关的量。根据题意不难得出,碳酸钠和氢氧化钙反应生成的碳酸钙沉淀的质量为4g,因此根据碳酸钙的质量就可求出20g碳酸钠溶液中碳酸钠的质量,在应用溶质质量分数的计算公式即可得出答案。
(3)设20g碳酸钠溶液中碳酸钠的质量为x
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
106 100
x 4g
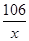 =
=
x=4.24g
碳酸钠溶液中溶质的质量分数为
 ×100%=21.2%
×100%=21.2%答:碳酸钠溶液中溶质的质量分数为21.2%

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目




