题目内容
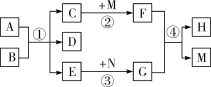
【题目】A~F是初中化学中常见的物质。反应条件已略去。图中反应③、④、⑦体现了C物质不同的化学性质,其中A、D是红色固体,C是世界上年产量最大的金属,A、F中含有同种非金属元素。请回答下列问题。
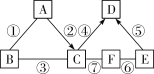
(1)写出符合题意的A的化学式_______。
(2)反应①在实际中的应用是________。
(3)写出一个反应②的化学方程式________。
(4)图中一定属于置换反应的是________。(填序号)
【答案】Fe2O3 除铁锈 3CO+Fe2O3![]() 2Fe+3CO2 (合理即可) ③④
2Fe+3CO2 (合理即可) ③④
【解析】
C是世界上年产量最大的金属,为铁,A、D为红色固体,A能生成铁,则A为氧化铁,铁能生成D,则D为铜,③④⑦体现了铁的不同化学性质,B能与氧化铁和铁都反应,B为酸,F和铁能反应,A、F中含有同种非金属元素,则F为氧气,E可为一氧化碳、氢气等还原性物质。(1)A的化学式为Fe2O3;(2)①为氧化铁与酸的反应,为除锈的反应原理;(3)反应②是氧化铁生成铁,可利用一氧化碳、氢气、碳等还原性物质与氧化铁反应实现;(4)③为铁与酸反应,④为铁与铜盐的反应,一定属于置换反应。

【题目】钠是一种活泼金属,常温下能与氧气、水等物质发生反应。钠与水反应的化学方程式为:2Na+2H2O==2NaOH+H2↑。在实验室,小亮先取定量的硫酸铜溶液于烧杯中,再取一小块钠投入硫酸铜溶液中,充分反应后过滤,得到滤液和蓝色滤渣,并对滤被的成分进行探究。
(提出问题)滤液中溶质的成分是什么?
(查阅资料)Na2SO4溶液呈中性
(猜想与假设)猜想一:Na2SO4
猜想二:Na2SO4和NaOH
猜想三:____________
猜想四:Na2SO4、CuSO4和NaOH
小明认为猜想______不合理,理由是_______(用化学方程式表示)。
(实验与验证)
实验 | 实验操作 | 实验現象 | 实验结论 |
实验一 | 取少量滤液于试管中,仔细观察现象 | 溶液为无色 | 猜想_____不成立 |
实验二 | 向实验一所取滤液中滴入酚酞溶液 | ________ | 猜想二不成立 |
实验三 | 常温下,再取少量滤液,测溶液酸碱度 | pH=7 | 猜想_____成立 |
(拓展延伸)金属活动性顺序表中钠及前面的金属____(填“能”或“不能”)把位于后面的金属从它们盐溶液里置换出来。
【题目】硫酸铜溶液对过氧化氢的分解有催化作用,取一定质量8.5%的过氧化氢溶液倒入烧杯中,加入一定质量15%的硫酸铜溶液,过氧化氢完全分解,有关实验数据如表所示(不考虑气体在水中的溶解).请计算:
反应前 | 反应后 | ||
实验数据 | 烧杯和过氧化氢溶液的质量/g | 硫酸铜溶液的质量/g | 烧杯和烧杯中溶液的质量/g |
60 | 3.3 | 62.5 | |
(1)生成氧气的质量为________.
(2)反应后烧杯中溶液溶质的质量分数.(写出计算过程,结果精确到0.1%).