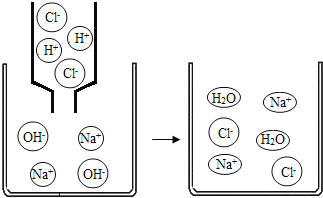
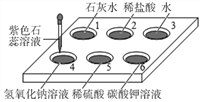
题目内容
【题目】为探究酸的性质,同学们设计了如下实验,请你参与.

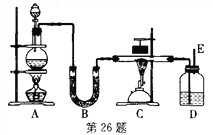
检验物质.按图23实验,可确定X是盐酸,则Y可以是_____.
(1)确定溶质成分.由图24实验,A中固体全部溶解,B中有白色沉淀产生,得出结论:A中溶质只有硫酸铁.有同学认为该结论不合理.接着向试管B中滴加氢氧化钠溶液,且产生沉淀的量随氢氧化钠溶液量的关系如图25所示.则:A中溶质有_____.实验中,A中发生反应的化学方程式为_____;a~b段对应溶液中一定发生反应的化学方程式为_____;c点对应溶液中含有溶质可能的组成有_____.
(2)由以上实验总结酸的化学性质有_____.
【答案】 碳酸钠溶液 H2SO4、Fe2(SO4)3 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O NaOH+HCl=NaCl+H2O NaCl;NaCl,BaCl2;NaCl,Na2SO4; 酸能与盐、金属氧化物、碱反应
【解析】银离子遇到氯离子产生白色的沉淀,x遇到硝酸银出现白色沉淀,只能说明含有氯离子,要证明是盐酸,还与加入碳酸钠,如有气体生成,则是盐酸;(1)由图可知a-b段沉淀没有增加,说明氢氧化钠在和硫酸反应,故有硫酸,b-c段有沉淀生成,且溶液中有硫酸铁生成,则有硫酸铁存在,故含有硫酸和硫酸铁;A中发生反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;A试管中有稀硫酸和硫酸铁,A中加入氯化钡,B中有三种可能,1、硫酸有剩余,2、硫酸和硫酸铁都有剩余,3、氯化钡有剩余,当硫酸有剩余时,加入氢氧化钠有硫酸钠生成,当硫酸没有剩余时,溶质只有氯化钠,当氯化钡有剩余时,氯化钡不会和氢氧化钠反应,最终由氯化钡和氯化钠的混合物,三种情况中都有氯化钠生成,所以,c点的溶质可能为NaCl;NaCl,BaCl2;NaCl,Na2SO4; (2)酸能与盐、金属氧化物、碱反应