��Ŀ����
����Ŀ������ͭ��Һ�Թ�������ķֽ��д����ã�ȡһ������8.5%�Ĺ���������Һ�����ձ��У�����һ������15%������ͭ��Һ������������ȫ�ֽ⣬�й�ʵ�����������ʾ��������������ˮ�е��ܽ⣩������㣺
��Ӧǰ | ��Ӧ�� | ||
ʵ������ | �ձ�����������Һ������/g | ����ͭ��Һ������/g | �ձ����ձ�����Һ������/g |
60 | 3.3 | 62.5 | |
��1����������������Ϊ________��
��2����Ӧ���ձ�����Һ���ʵ�������������д��������̣������ȷ��0.1%����
���𰸡���1��0.8����2��2.3%��
��������
�����������1�����������غ㶨�ɣ�����������=(60g+3.3g)��62.5g=0.8g��
��2�������������Һ������H2O2������Ϊx
2H2O2![]() 2H2O+O2��
2H2O+O2��
68 32
x 0.8g
![]() ,���x=1.7g�������������Һ������=1.7g��8.5%==20g������ͭ������=3.3g��15%=0.495g���ʷ�Ӧ���ձ�����Һ���ʵ���������=
,���x=1.7g�������������Һ������=1.7g��8.5%==20g������ͭ������=3.3g��15%=0.495g���ʷ�Ӧ���ձ�����Һ���ʵ���������=![]() ��100%��2.3%��
��100%��2.3%��

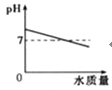
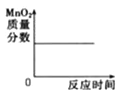
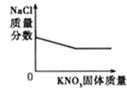
����Ŀ������ͼ��������ȷ��ʾ��仯���̵��ǣ� ��
|
|
A����pH=10��KOH��Һ�в��ϼ�ˮϡ�� | B����һ��������KClO3��MnO2�Ļ������ȡO2 |
|
|
C����FeCl3��HNO3�Ļ����Һ�м���NaOH��Һֱ������ | D��20��ʱ����һ��������NaCl��Һ�м���KNO3���� |