题目内容
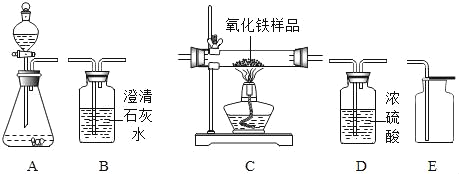
【题目】为粗略测定某石灰石中碳酸钙的含量进行如下实验。(装置气密性良好,杂质不参与反应)
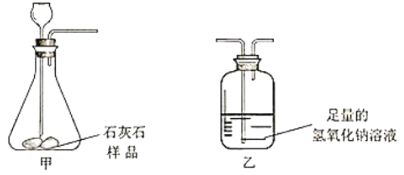
步骤I:称量装置甲和盛放的石灰石样品的总质量;装置乙和盛放的氢氧化钠溶液的总质量。步骤II:连接装置甲和乙,盐酸由长颈漏斗加入到锥形瓶中至气泡不再产生为止。
步骤III:二氧化碳被完全吸收后,测得装置甲及其盛放的药品增重了37.8克;装置乙及其盛放的药品增重了2.2克。
(1)盐酸中的溶质是______(填写名称)。
(2)二氧化碳与氢氧化钠溶液反应的化学方程式是______。装置乙吸收的二氧化碳为______摩尔。
(3)该石灰石样品中碳酸钙物质的量_____。(根据化学方程式列式计算)
(4)实验中所加的盐酸溶质质量分数可能为______(选填编号)。
a 5% b 7% c 10%
(5)如所用的盐酸溶质质量分数过大,对碳酸钙含量测定结果的影响是______(选填“偏大”“偏小”或“无”),理由是______。
【答案】氯化氢 2NaOH+CO2=Na2CO3+H2O 0.05 0.1mol c 偏大 盐酸浓度过高,易挥发被乙装置吸收,在计算时被计入CO2的质量,从而CaCO3质量偏大
【解析】
(1)盐酸是氯化氢气体溶解于水得到的,所以溶质的名称是 氯化氢。
(2)二氧化碳与氢氧化钠溶液反应生成碳酸钠和水,对应的化学方程式是2NaOH+CO2=Na2CO3+H2O.装置乙吸收的二氧化碳的物质的量为![]() =0.05mol。
=0.05mol。
(3)设该石灰石样品中碳酸钙物质的量为x。消耗的HCl的物质的量为y

![]() =
=![]()
x=0.05mol
![]() =
=![]()
y=0.1mol
(4)测得装置甲及其盛放的药品增重了37.8克;装置乙及其盛放的药品增重了2.2克,即加入的盐酸浓溶液的质量为37.8g+2.2g=40g,假如消耗完全反应,则所用稀盐酸的质量分数为![]() ×100%≈9%,所以实验中所加的盐酸溶质质量分数应该大于9%,所以可能为10%.故选:c
×100%≈9%,所以实验中所加的盐酸溶质质量分数应该大于9%,所以可能为10%.故选:c
(5)如所用的盐酸溶质质量分数过大,对碳酸钙含量测定结果的影响是 偏大(选填“偏大”“偏小”或“无”),理由是 盐酸浓度过高,易挥发被乙装置吸收,在计算时被计入CO2的质量,从而CaCO3质量偏大。
故答案为:
(1)氯化氢。
(2)2NaOH+CO2=Na2CO3+H2O. 0.05。
(3)0.05mol;
(4)c。
(5)偏大; 盐酸浓度过高,易挥发被乙装置吸收,在计算时被计入CO2的质量,从而CaCO3质量偏大。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案