题目内容
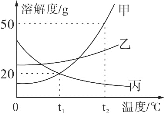
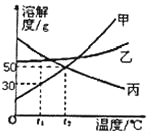
【题目】根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
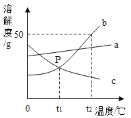
(1)若b中混有少量a,可用____(填“蒸发结晶”或“降温结晶”)的方法提纯b。
(2)将t2℃ 时b、c两种物质的饱和溶液降温至t1℃,两种溶液的溶质质量分数的大小关系为b____c(填“>”“=”或“<”)。
【答案】降温结晶 >
【解析】
(1)a、b两物质的溶解度都随温度降低而降低,b物质的溶解度受温度变化影响较大,a物质溶解度受温度影响较小。所以b中混有少量a,可用降温结晶的方法提纯b;
(2)将t2℃时b、c两种物质的饱和溶液降温到t1℃时,b的溶解度减小,c的溶解度随温度的降低而增大,b溶液有晶体析出,质量分数变小,溶液仍为饱和溶液,c溶液没有晶体析出,质量分数不变,一定温度下饱和溶液的溶质质量分数=![]() ,溶解度越大,质量分数越大,t1℃时b的溶解度大于t2℃时c的溶解度,所以t1℃时两种物质的溶质质量分数由大到小的顺序是b>c。
,溶解度越大,质量分数越大,t1℃时b的溶解度大于t2℃时c的溶解度,所以t1℃时两种物质的溶质质量分数由大到小的顺序是b>c。

 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
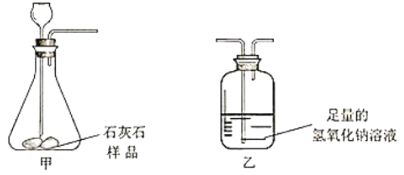
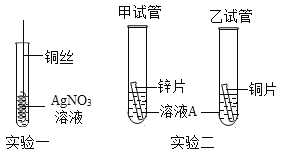
波波熊暑假作业江西人民出版社系列答案【题目】某化学兴趣小组做了如图所示实验,当向乙烧杯中依次加入MnO2和H2O2溶液时,发现有大量气泡产生,并产生大量白雾,蜡烛燃烧更旺,但过一会儿逐渐熄灭。而甲烧杯中蜡烛一直持续燃烧。
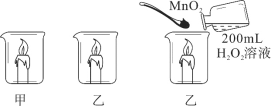
(知识回忆)写出过氧化氢分解产生氧气的化学方程式:_____。
(问题1)导致乙烧杯中蜡烛熄灭的原因是什么?
(作出猜想)猜想一:燃烧产生的CO2使蜡烛熄灭;
猜想二:白雾是水雾导致蜡烛熄灭;
小组同学经过讨论,排除了猜想一,其理由是_____。
(实验1)向一只装有燃者蜡烛的烧杯中加入100℃水,另一只依次加入MnO2和H2O2溶液,若观察到_____的现象,则猜想二正确。
(查阅资料)水雾产生与H2O2溶液的溶质质量分数大小有关,并且H2O2溶液的溶质质量分数越大,产生的水雾越多。
(问题2)为什么H2O2溶液的溶质质量分数越大水雾越多呢?
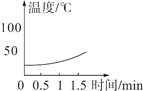
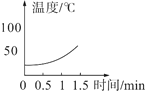
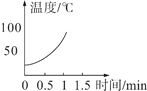
(实验2)分别向三只烧杯依次加入MnO2和溶质质量分数的不同H2O2溶液测定温度变化。
H2O溶液 | 5% | 10% | 30% |
温度变化曲线 |
|
|
|
(解释与结论)
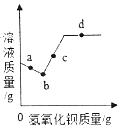
(1)该对比实验过程中不需要控制的条件是_____。
A H2O2溶液的初始温度相同 B 反应开始的时间相同 C 二氧化锰的质量相同
(2)根据实验2,可得出的一个结论是_____。