题目内容
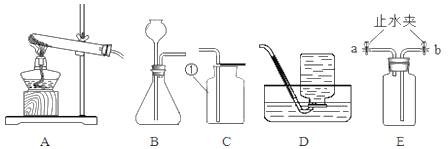
【题目】如图所示为实验室中常见的气体制备、干燥、收集和性质实验的部分仪器(组装实验装置时,可重复选择仪器)。试根据题目要求,回答下列问题:
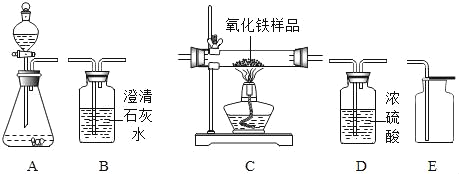
(1)以过氧化氢溶液和二氧化锰为原料制取并收集干燥的氧气,按照要求设计实验装置、连接仪器,并检验装置的气密性。
①所选仪器的连接顺序为_____(填写仪器序号字母)。
②制取氧气的化学方程式为_____。
(2)某化学兴趣小组的同学欲用CO气体(含有少量的CO2和水蒸气)测定氧化铁样品中Fe2O3的质量分数。现取2a g氧化铁样品进行相关测定,仪器的连接顺序为:CO气体→B1→D→C→B2→尾气处理(B1、B2为盛有澄清石灰水的洗气瓶)(假设杂质不发生反应,质量也不变化,各装置的作用都是充分的)。
①装置B1中观察到的实验现象为_____。
②反应结束后,若通过B2装置质量的变化进行测定,假设B2装置增重ag,则该样品中Fe2O3的质量分数为_____(结果精确到0.1%)。
③若不连接B1装置,通过测定反应前后C处大玻璃管的质量变化,来计算该样品中Fe2O3的质量分数。若其他操作正确,则计算结果将_____(填“偏大”“偏小”“不受影响之一)
【答案】ADE 2H2O2![]() 2H2O+O2↑ 澄清的石灰水变浑浊 60.6% 不受影响
2H2O+O2↑ 澄清的石灰水变浑浊 60.6% 不受影响
【解析】
解:(1)①以过氧化氢溶液和二氧化锰为原料制取氧气属于固液常温型,选择装置A来制取,用浓硫酸对氧气进行干燥,最后用向上排空气法来收集干燥的氧气;故填:ADE;
②过氧化氢在二氧化锰的催化作用下分解为水和氧气;故填:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)①二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀和水,所以装置B1中的现象是澄清的石灰水变浑浊;故填:澄清的石灰水变浑浊;
②反应结束后,若通过B2装置质量的变化进行测定,假设B2装置增重ag,这就是一氧化碳还原氧化铁生成的二氧化碳的质量,设氧化铁的质量为x,则:

![]()
x=![]()
则该样品中Fe2O3的质量分数为![]() ≈60.6%
≈60.6%
故填:60.6%;
③若不连接B1装置,通过测定反应前后C处大玻璃管的固体质量变化,来计算该样品中Fe2O3的质量分数。若其他操作正确,则计算结果不受影响;故填:不受影响。

 口算题天天练系列答案
口算题天天练系列答案【题目】按要求回答下列各题。
(1)在下表空格中填写相应的化学式。
氯化钾 | 氯化钙 | 氯化钠 | 氯化镁 | 氯化铝 | 氯化锌 | 氯化亚铁 |
KCl | CaCl2 | NaCl | _____ | AlCl3 | ZnCl2 | FeCl2 |
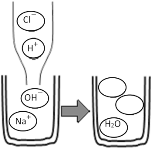
(2)如图表示稀盐酸和氢氧化钠溶液发生反应的微观过程,请你将如图空白圆圈中的离子符号填写到下面空格上_____、_______;请你说出盐酸与氢氧化钠反应的微观实质:____
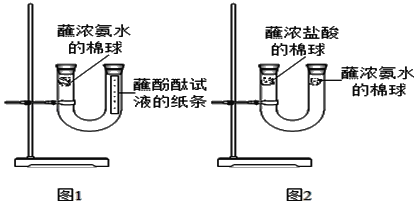
【题目】某些铜制品在空气中久置,表面生成绿色的铜锈(又称铜绿)。某化学实验小组设计并进行实验,探究铜锈的组成和铜生锈的条件。
I.探究铜锈的组成
(查阅资料)①铜锈受热易分解 ②硫酸铜粉末遇水由白色变为蓝色
(进行实验)小组同学从铜器上取下适量的干燥铜锈,按图所示装置实验(部分夹持装置已略去)。观察到B中白色粉末变为蓝色,C中澄清石灰水变浑浊。
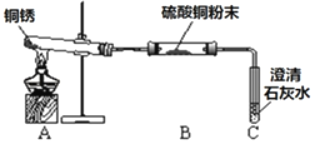
(解释与结论)依据以上现象分析,铜锈中一定含有的元素:Cu和_____。
II.探究铜生锈的条件
(提出猜想)根据铜锈的组成推测,铜生锈可能与CO2、H2O和O2有关。
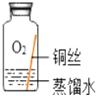
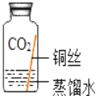
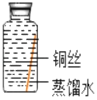
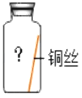
(进行实验)实验小组同学取直径、长度均相同的铜丝,并打磨光亮。设计了如图所示的5个实验并持续观察。
编号 | ① | ② | ③ | ④ | ⑤ |
实验 |
|
|
|
|
|
现象 | 无明显现象 | 无明显现象 | 铜丝表面 有绿色物质 | 无明显现象 | 无明显现象 |
(解释与结论)
(1)实验中使用“经煮沸迅速冷却的蒸馏水”,其目的是_____。
(2)得出“铜生锈一定与CO2有关”的结论,依据的两个实验是_____(填编号)。
(3)对比实验②和③,得出的结论是_____。
(4)为验证猜想,实验⑤的集气瓶中的气体是_____。
(5)由上述实验可推知,铜生锈的条件是_____。
(反思与应用)
(6)防止金属锈蚀的方法是_____(写一种)。