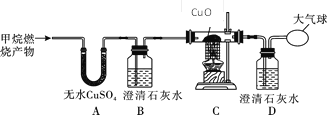
题目内容
【题目】甲、乙两种固体物质的溶解度曲线如图所示。下列有关叙述中错误的是
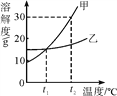
A. t1 ℃时,甲物质的溶解度与乙物质的溶解度相等
B. t2 ℃时,将20 g甲物质放入50 g水中,所得溶液为饱和溶液
C. 升高温度可将甲物质的饱和溶液变为不饱和溶液
D. 当甲物质中含少量乙物质时,可用蒸发溶剂的方法提纯甲物质
【答案】D
【解析】由图中信息知,A、t1 ℃时,甲物质的溶解度与乙物质的溶解度相等,两曲线相交,溶解度相等,故A正确;B、t2 ℃时,甲物质溶解度是30个,将20 g甲物质放入50 g水中,最多溶解15g,所得溶液为饱和溶液,故B正确;C、甲物质溶解度随温度升高而增大,升高温度可将甲物质的饱和溶液变为不饱和溶液,故C正确;D、甲物质溶解度受温度影响较大,乙物质溶解度受温度影响变化不大,当甲物质中含少量乙物质时,可用蒸发结晶的方法提纯甲物质,故D错误。
点睛∶溶解度曲线的意义⑴表示同一种物质在不同温度时的溶解度或溶解度随温度变化的情况;⑵表示不同物质在同一温度时的溶解度,可以比较同一温度时,不同物质的溶解度的大小。若两种物质的溶解度曲线相交,则在该温度下两种物质的溶解度相等;⑶根据溶解度曲线可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法;⑷根据溶解度曲线能进行有关的计算。

【题目】阅读下面科普短文。
在中国古代化工发展的历史征程中,我国古代先民们在火药、制陶烧瓷、炼铜冶铁等化学加工技术方面取得了许多非凡的成就,为促进我国古代社会发展和人类的进步做出了重大的贡献。
【火药】人类最早使用的火药是黑火药,主要反应如下:

【制陶烧瓷】瓷器与陶器,都属于硅酸盐系列制品,最主要的化学成分是二氧化硅(SiO2)、氧化铝(Al2O3)及多种金属(Ca、Mg、Fe、K、Na等)氧化物。但在化学成分含量、用途等方面却大有区别。
制品 | 化学成分 | 性能用途等 |
陶器 | Al2O3 约15%~18%; Fe2O3约5%~6%; CaO、MgO等≥3%。 | 粗糙,不够坚硬,常用于取水、盛放食物等。 |
瓷器 | Al2O3 约18%~28%; Fe2O3约1%~2%; CaO、MgO等≤1%。 | 高温烧结,坚硬致密,洁白,薄, 呈半透明,敲击时清脆悦耳,美观,用途广泛,观赏、收藏价值高等。 |
【金属冶炼】制陶发展起来的高温技术为金属的冶炼、熔铸创造了条件,我国由新石器时代晚期逐步进入了先是炼铜(称为“青铜器时代”)后是炼铁(称为“铁器时代”)的金属时代。
青铜冶炼
天然铜夹杂在铜矿石之中,人们在加热熔化天然铜的过程中,将绿色的孔雀石[Cu2(OH)2CO3]、棕或黑色的锡石(SnO2)、蓝色的方铅矿(PbS)放在一起烧,便产生了青铜。青铜是铜与锡或铅熔成的合金。熔点比纯铜(1083℃)低100℃~300℃,更易加工和铸造,铸造性能也比纯铜好,硬度几乎提高一倍,适合制作工具和兵器。
铁的冶炼
到了春秋中后期,我国先民们在熟悉地掌握了块炼法炼铁后,又在世界上率先发明了以高温液体还原法冶炼生铁的技术,这在冶金史上是一个划时代的进步。
随着炼铁技术的进步,人们也逐渐懂得了炼钢。生铁和钢都是铁碳合金。含碳量>2%,为生铁;含碳量<0.02%,为纯铁;含碳量在两者之间为钢。依据文章内容回答下列问题。
(1)黑火药的主要成分是________。
(2)陶器与瓷器化学成分的主要区别是_________。
(3)生铁的碳含量______(填“高于”或“低于”)钢的碳含量。
(4)与纯金属相比,合金的优点可能是________。
【答案】 硝酸钾、木炭、硫(KNO3 、C、S) 陶瓷中Al2O3含量比瓷器低,Fe2O3、CaO、MgO含量比瓷器高 高于 硬度大、熔点低
【解析】本题考查了根据短文黑火药、陶器与瓷器化学成分,铁合金的成分和性质,认真阅读短文是解题的关键。
(1)从题中提供的化学方程式可知,黑火药的主要成分是硝酸钾、木炭、硫(KNO3 、C、S);
(2)根据陶器与瓷器化学成分表可知,陶器与瓷器化学成分的主要区别是:陶瓷中Al2O3含量比瓷器低,Fe2O3、CaO、MgO含量比瓷器高;
(3)生铁和钢都是铁碳合金。含碳量>2%,为生铁;含碳量<0.02%,为纯铁;含碳量在两者之间为钢。生铁的碳含量高于钢的碳含量;
(4)与纯金属相比,合金的优点可能是:硬度大、熔点低。
【题型】简答题
【结束】
21
【题目】工业上制取硝酸铵(NH4NO3)的流程图如下,请回答下列问题。
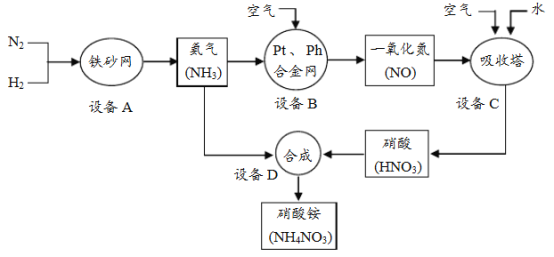
(1)设备A中,发生的反应属于基本反应类型中的________。
(2)设备B、C中,空气中的______一定参加了反应。
(3)设备C中,生产硝酸过程排出的废气中会含有一些氮的氧化物,可用如下两种
方法处理:
方法一、NaOH溶液吸收法:NO + NO2 + 2NaOH = 2NaNO2 + H2O
方法二、NH3还原法:8NH3 + 6NO2![]() 7N2 + 12H2O(NO也有类似的反应)
7N2 + 12H2O(NO也有类似的反应)
以上两种方法中,你认为哪种方法好并说明理由________。
(4)设备D中,用NH3和HNO3制备NH4NO3。NH4NO3中氮元素质量分数的计算式为________。