��Ŀ����
����Ŀ��Ϊ�ȽϽ���������ͬpH��ϡ���ᡢϡ���ᷴӦ������������������ʵ��̽������ش��������⣺
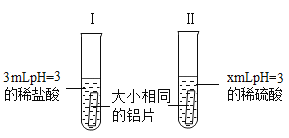
��1������ϡ���ᷴӦ�Ļ�ѧ����ʽΪ____________________.
��2��x=_____________��ʵ������п�ͨ���۲�ȽϷ�Ӧ�ľ��ҳ̶�ȷ����Ӧ������
��3����ʵ������У���������ϡ���ᷴӦ�����ң�Ϊ�˶�������������²��룺
������٣��Թ�I��_________�Է�Ӧ���˴ٽ����ã�
������ڣ��Թܢ�����������ӶԷ�Ӧ�����谭���á�
��4��Ϊ����֤���������Ƿ���ȷ����Ҫ���Թ�l�м�������____________�����Թܢ��м�������___________���Ա�ʵ�飨�����ʱ�ţ���
A ����ͭ B ������ C �Ȼ��� D ϡ����
��5��ͨ����4���еĶԱ�ʵ�飬�۲쵽�Թ�1�з�Ӧ���������Ա仯���Թܢ��з�Ӧ���ԼӾ磬��ɵó��Ľ�����______________________________.
���𰸡�![]() 3 ������ B C ����һ��ȷ
3 ������ B C ����һ��ȷ![]() ��������ķ�Ӧ���дٽ����ã�
��������ķ�Ӧ���дٽ����ã�![]() ��������ķ�Ӧ����������
��������ķ�Ӧ����������
��������
��1������ϡ���ᷴӦ�����Ȼ�������������Ӧ�Ļ�ѧ����ʽΪ��![]() ��
��
��2������Ҫ���Ƶ�һ��������IJ�ͬ������������Ӧ����һ�£�����ϡ����Ӧ��Ϊ3mL������x=3��ʵ������У�����ͨ���۲����ݲ����Ŀ������Ƚ�����ϡ�����ϡ���ᷴӦ�ľ��ҳ̶ȡ�
��3��ʵ����ϡ������ϡ���ͬ����������ӵIJ�ͬ������ϡ���ᷴӦ�����ң������������ӶԷ�Ӧ���˴ٽ����ã�Ҳ��������������ӶԷ�Ӧ�����谭���ã��ʣ�
����٣��Թ�I�������ӶԷ�Ӧ���˴ٽ����ã�
����ڣ��Թܢ�����������ӶԷ�Ӧ�����谭���á�
��4��Ϊ����֤���������Ƿ���ȷ�������Թ�I�м�����������ӣ����Թܢ��м��������ӣ�����������ʲ�������Ӧ�����ı����Ũ������������Ҫ���Թ�I�м������������ƣ���ѡ����ͭ��ԭ��������ͭ��������Ӧ�����Թܢ��м��������Ȼ������Ա�ʵ�飬��ѡϡ�����ԭ���Ǽ���ϡ�����ı��Թܢ����������ʧȥ�ɱ��ԡ�
���B��C��
��5��ͨ����4���еĶԱ�ʵ�飬�۲쵽�Թ�1�з�Ӧ���������Ա仯���Թܢ��з�Ӧ���ԼӾ磬��ɵó��Ľ����ǣ�����һ��ȷ��![]() ��������ķ�Ӧ���дٽ����ã�
��������ķ�Ӧ���дٽ����ã�![]() ��������ķ�Ӧ���������á�
��������ķ�Ӧ���������á�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��2019 �� 3 �� 22 ���ǵڶ�ʮ�߽�������ˮ������
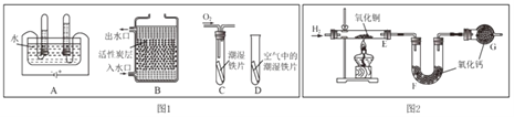
��1������ͼ 1 �ش��������⡣
��A ͼ��ʾ���ǵ��ˮʵ�飬д���÷�Ӧ�Ļ�ѧ����ʽ______��
��B ͼ��ʾ���ǻ���̿��ˮ����ʾ��ͼ�����л���̿��������______��
��C��D ͼ��ʾ����̽��������������ʵ�飬һ��ʱ����� C ����Ƭ��죬D ����Ƭ�� Ȼ�������Ա� C��D �е�����˵��Ӱ�������������һ����Ҫ������______��
��2��������������Ϊ 10%������������Һ���ܶ�Ϊ 1.1g/cm3������ 220g ��������Ϊ 5%�� ����������Һ��
����Ҫ 10%������������Һ���Ϊ______mL��
��ʵ�������Ƹ���Һ����Ҫ�����У����㡢��ȡ��______��װƿ�����ϱ�ǩ��
������ȡ����������Һ����ʱ���ӣ��������������ȷ��������õ���Һ�������������� ��______������ƫ��������ƫ����������Ӱ��������
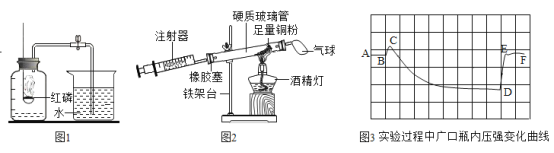
��3��������ͼ 2 ʵ��װ�òⶨˮ����ɡ� ��Ӧǰ���õ� E��F װ���������ݼ�����
װ�� E | װ�� F | |
��Ӧǰ������/g | 38.2 | 212.4 |
��Ӧ�������/g | a | 214.2 |
�����ⶨˮ���⡢��Ԫ�ص������ȷ�������ֵ������� a ����ֵ��______��
�����������У��Բⶨ�����Ӱ�����______������ĸ����
ACuO ��ĩ������ BCuO û����ȫת��Ϊ Cu Cû�� G װ��