题目内容
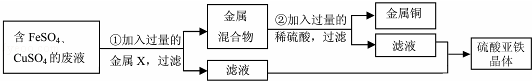
在硫酸铜和硫酸亚铁的混合溶液中加入一定量的锌粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气泡产生。下列判断不正确的是
| A.滤出的固体中一定含有铜 | B.滤出的固体一定含有铁 |
| C.滤液中一定含有硫酸锌 | D.滤液中可能含有硫酸铜 |
D
试题分析:在硫酸铜和硫酸亚铁的混合溶液中加入一定量的锌粉,则锌将置换出铜和铁,若锌足量,则铜和铁全部被置换出来,否则锌全部反应完,而硫酸铜和硫酸亚铁可能有剩余。向滤出的固体中滴加稀硫酸,有气泡产生,则要么铁被置换出来了,要么锌有剩余。故滤出的固体中一定含有铜;滤出的固体一定含有铁;滤液中一定含有硫酸锌;滤液中不可能含有硫酸铜。选D。
点评:金属活动性顺序:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au。
在金属活动性顺序中,氢前的金属能与酸发生置换反应,且位置越靠前,反应越剧烈;位置在前的金属能把位于其后的金属从其盐溶液中置换出来。

练习册系列答案
相关题目