题目内容
(1)下列三种金属被发现、使用的先后顺序为:铜、铁、铝.金属大规模被使用的先后顺序跟(选填字母) (A.地壳中金属元素的含量 B.金属的导电性 C..金属的活动性)关系最大.
(2)铁制品锈蚀的过程,实际上是铁与空气中的 和 等发生化学反应的过程.据有关资料报导,世界上每年因腐蚀而报废的金属设备或材料相当于年产量的20%~40%.保护金属资源,人人有责.请写出一条防止铁制品生锈的方法 .目前世界上已有50%以上的废钢铁得到回收利用,其目的是(选填字母) .
A.节约金属资源
B.减少矿物开采,合理利用资源
C.防止钢铁生锈
(3)工人师傅切割铁板时,常用硫酸铜溶液在铁板上画线即可留下红色的印迹,此过程中发生的化学方程式为 .
(4)某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下实验方案.结合如图实验方案回答下列问题:?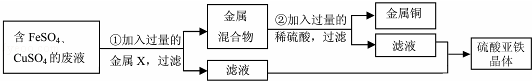
步骤①中,金属X是 ;?
步骤②中,加入过量稀硫酸的目的是 ,该反应的化学方程式为 .
(2)铁制品锈蚀的过程,实际上是铁与空气中的 和 等发生化学反应的过程.据有关资料报导,世界上每年因腐蚀而报废的金属设备或材料相当于年产量的20%~40%.保护金属资源,人人有责.请写出一条防止铁制品生锈的方法 .目前世界上已有50%以上的废钢铁得到回收利用,其目的是(选填字母) .
A.节约金属资源
B.减少矿物开采,合理利用资源
C.防止钢铁生锈
(3)工人师傅切割铁板时,常用硫酸铜溶液在铁板上画线即可留下红色的印迹,此过程中发生的化学方程式为 .
(4)某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如下实验方案.结合如图实验方案回答下列问题:?

步骤①中,金属X是 ;?
步骤②中,加入过量稀硫酸的目的是 ,该反应的化学方程式为 .
(1)C (2)氧气 水 涂油漆 AB (3)Fe+CuSO4=Cu+FeSO4
(4)Fe 除去过量的铁 Fe+H2SO4=H2↑+FeSO4
(4)Fe 除去过量的铁 Fe+H2SO4=H2↑+FeSO4
试题分析:(1)根据金属制取的难易程度考虑;
(2)根据铁生锈的条件,防止生锈的措施、回收废钢铁的意义分析;
(3)依据在金属活动性顺序中排在前面的金属可以把排在它后面的金属从盐溶液中置换出来解答即可;
(4)由于目的是获得铜单质和硫酸亚铁,所以需要将铜离子转化为铜单质,而溶液中需要的是硫酸亚铁而不能引入新的杂质,所以加入的能够将铜离子转化为铜单质的只能是单质铁;由于加入的铁是过量的,加入过量稀硫酸的目的是除去铜中的铁,根据反应写出反应的方程式.
解:(1)金属越活泼的越不容易制取,所以与金属活动性有关;
(2)铁制品锈蚀的过程,实际上是铁与空气中的氧气和水等发生的反应,为了防止铁制品生锈可在其表面涂油漆;废钢铁得到回收利用,可以节约金属资源,减少矿物开采,合理利用资源等;
(3)由于铁的金属活动性比铜强,所以铁可以置换出硫酸铜中的铜,铜是红色物质,所以反应后可留下红色痕迹.此反应的方程式是:Fe+CuSO4=Cu+FeSO4;
(4)由题意可知,由于需要将铜离子转化为铜单质,而溶液还必须为硫酸亚铁,即不能引入新的杂质,所以可以加入铁将铜离子转化为铜单质.在骤②中,加入过量稀硫酸的目的是除去铜中的铁,反应的方程式是:Fe+H2SO4=H2↑+FeSO4.
故答为:(1)C,(2)氧气,水,涂油漆,AB(3)Fe+CuSO4=Cu+FeSO4;(4)Fe,除去过量的铁,Fe+H2SO4=H2↑+FeSO4.
点评:本题主要考查了金属的性质和应用.解答本题的最后一小题时要注意混合物的分离要考虑为彻底分开而加入过量试剂,所以后一环节需要将之除去.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 2CO
2CO H2O+NH3↑+CO2↑
H2O+NH3↑+CO2↑