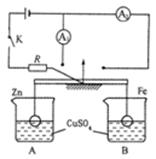
题目内容
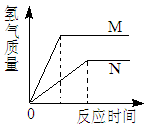
相同质量的M、N两种活泼金属,分别与足量质量分数为8%的盐酸反应(M、N在生成物中均为+2价),生成H2质量和反应时间的关系如右图。下列叙述正确的是( )

| A.金属的活泼性N>M | B.两个反应生成H2的体积相等 |
| C.相对原子质量N>M | D.两个反应消耗盐酸的质量一定相等 |
C
试题分析:根据金属与酸的反应,结合图像分析解答。
A、根据图象可知,纵坐标表示氢气质量,横坐标表示时间,则斜率表示反应的速度,M的斜率比N的大,说明M比N反应的速度快,所以M比N活泼,故A错误;
B、根据图象可知,最终M产生的氢气多,N产生的氢气少,两种金属反应产生的氢气的质量不同,体积也不可能相等,故B错误;
C、由于M产生的氢气比N多,而根据化学方程式计算可知,价态相同的金属与足量的酸反应,相对原子质量越大,产生的氢气越少,说明N的相对原子质量大,故C正确;
D、由于氢气均来自于反应消耗的盐酸中的氢元素,又M产生的氢气比N多,说明它们消耗盐酸的质量不相等,故D错误。故选C
点评:在金属活动性顺序中,氢前的金属能置换出酸中的氢,金属的位置越靠前,反应的速率越快;价态相同的金属与足量的酸反应,相对原子质量越大,产生的氢气越少;同时要明确图象中折点的含义,即至少有一种物质完全反应,氢气的质量不再改变。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 2CO
2CO H2O+NH3↑+CO2↑
H2O+NH3↑+CO2↑
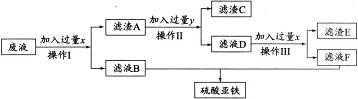
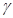 是____;写出上述有关反应的化学方程式______________。
是____;写出上述有关反应的化学方程式______________。