题目内容
【题目】化学研究性小组做酸碱中和实验。当小组的同学将稀盐酸滴入所配制的氢氧化钠溶液进行中和实验时,发现有气泡产生,小组同学产生质疑,要对这瓶变质的氢氧化钠固体进行探究。
(1)[分析] 氢氧化钠固体曝露在空气中不仅吸收,还可以与空气中二氧化碳反应而变质,写出该反应的化学方程式________________________________。
[猜想假设] 猜想一:该氢氧化钠样品部分变质。猜想二:该氢氧化钠样品全部变质。
(2)[设计方案]
实验操作 | 实验现象 | 实验结论 |
取少量固体于试管中加水溶解,滴入适量澄清石灰水 | 产生白色沉淀 | 猜想一正确 |
取上层清液放入另一只试管中,滴加酚酞溶液 | 溶液变红 |
同学们经过研讨,认为此方案不合理。方案不合理的原因____________________________。
(3)同学们重新设计了方案并进行了实验。
[实验探究]
实验操作 | 实验现象 | 实验结论 |
取少量固体放入试管中加水溶解,滴入足量的_______________________ 。 | 产生白色沉淀 | 猜想一正确 |
取上层清液放入另一只试管中,滴加酚酞溶液 | 溶液变红 |
(4)[继续探究] 同学们继续探究该氢氧化钠样品中碳酸钠的质量分数。利用以下装置进行了实验。
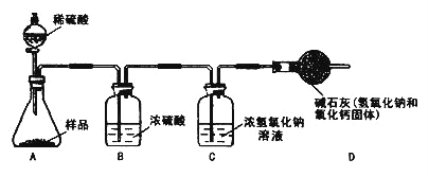
你认为他们需要测的数据是____________(填字母序号)。
a.固体样品的质量 b.碱石灰实验前后的质量
c.浓硫酸的质量 d.浓氢氧化钠溶液实验前后的质量
e.所用稀硫酸的质量
(5)[实验反思] 根据所得数据进行计算发现结果比实际值偏小,原因可能是____________。
【答案】 略 碳酸钠与石灰水反应产生的氢氧化钠也能使滤液中的酚酞变红 氯化钙溶液(其他合理答案也可) ad A、B容器内还有剩余的二氧化碳没有完全被氢氧化钠吸收
【解析】(1)氢氧化钠易与空气中的二氧化碳反应生成碳酸钠和水而变质,反应的化学方程式表示为2NaOH+CO2===Na2CO3+H2O;(2)由于碳酸钠与石灰水反应产生的氢氧化钠也能使滤液中的酚酞变红,故不能判断使无色酚酞变红色的是原溶液中的氢氧化钠还是生成的氢氧化钠,故方案不合理;(3)由于碳酸钠和氢氧化钠均呈碱性,故要判断氢氧化钠的存在,要先加入一种中性溶液如氯化钙将碳酸钠除去,再用无色酚酞来检验氢氧化钠的存在。方法是:取少量固体放入试管中加水溶解,滴入足量的氯化钙溶液,产生白色沉淀,说明含有碳酸钠,再取上层清液放入另一只试管中,滴加酚酞溶液,无色酚酞变成红色,说明含有氢氧化钠,即猜想一正确;(4)探究该氢氧化钠样品中碳酸钠的质量分数,可通过加入稀硫酸后测定生成的二氧化碳的质量来计算碳酸钠的质量,故需要测的数据是固体的总质量和浓氢氧化钠溶液实验前后的质量,选ad;(5)A、B容器内还有剩余的二氧化碳没有完全被氢氧化钠吸收,故会导致c装置中增加的质量减少,即测得的二氧化碳的质量减少,那么碳酸钠的质量会偏小。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案