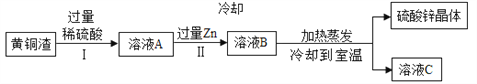
题目内容
【题目】根据下面的实验过程和提供的数据,回答下列问题。(不考虑反应中水分的蒸发,假设生成的气体全部逸出)

(1)生成二氧化碳的质量 g 。
(2)计算大理石中碳酸钙的质量。
(3)过滤后所得溶液中溶质CaCl2的质量分数。
【答案】(1)4.4g;(2)10g;(3)10%
【解析】(1)据质量守恒定律可知反应前后物质的总质量不变,所以二氧化碳的质量为12.5g+105.4-113.5g=4.4g;
设大理石中碳酸钙的质量为x,生成氯化钙的质量为y
CaCO3 +2HCl ==CaCl2+ CO2↑ + H2O
100 111 44
x y 4.4g
100/x=111/y=44/4.4g
X=10g y=11.1g
过滤后所得溶液中溶质CaCl2的质量分数![]() =10%
=10%
答:略

【题目】化学研究性小组做酸碱中和实验。当小组的同学将稀盐酸滴入所配制的氢氧化钠溶液进行中和实验时,发现有气泡产生,小组同学产生质疑,要对这瓶变质的氢氧化钠固体进行探究。
(1)[分析] 氢氧化钠固体曝露在空气中不仅吸收,还可以与空气中二氧化碳反应而变质,写出该反应的化学方程式________________________________。
[猜想假设] 猜想一:该氢氧化钠样品部分变质。猜想二:该氢氧化钠样品全部变质。
(2)[设计方案]
实验操作 | 实验现象 | 实验结论 |
取少量固体于试管中加水溶解,滴入适量澄清石灰水 | 产生白色沉淀 | 猜想一正确 |
取上层清液放入另一只试管中,滴加酚酞溶液 | 溶液变红 |
同学们经过研讨,认为此方案不合理。方案不合理的原因____________________________。
(3)同学们重新设计了方案并进行了实验。
[实验探究]
实验操作 | 实验现象 | 实验结论 |
取少量固体放入试管中加水溶解,滴入足量的_______________________ 。 | 产生白色沉淀 | 猜想一正确 |
取上层清液放入另一只试管中,滴加酚酞溶液 | 溶液变红 |
(4)[继续探究] 同学们继续探究该氢氧化钠样品中碳酸钠的质量分数。利用以下装置进行了实验。
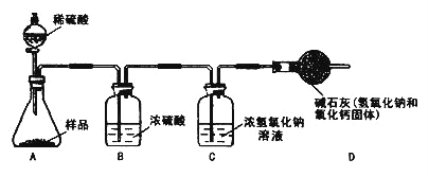
你认为他们需要测的数据是____________(填字母序号)。
a.固体样品的质量 b.碱石灰实验前后的质量
c.浓硫酸的质量 d.浓氢氧化钠溶液实验前后的质量
e.所用稀硫酸的质量
(5)[实验反思] 根据所得数据进行计算发现结果比实际值偏小,原因可能是____________。