题目内容
【题目】CaCO3在生产生活中有广泛的用途.
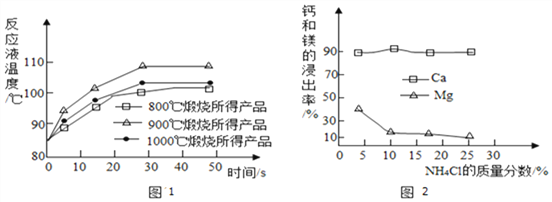
(1)煅烧石灰石可制得活性CaO,反应的化学方程式为___________。为测定不同煅烧温度对CaO活性的影响,某化学兴趣小组进行了如下实验:
Ⅰ.取石灰石样品分为三等份,在同一设备中分别于800℃、900 ℃和1000℃条件下煅烧;
Ⅱ.所得固体分别与等质量的水完全反应,测得反应液温度随时间的变化如图1所示。上述温度中,___________℃时煅烧所得CaO活性最高。
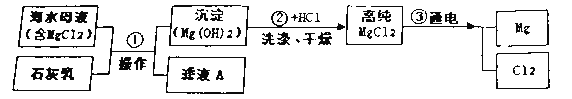
(2)以电石渣(主要成分为Ca(OH)2,还含有少量MgO等杂质)为原料制备高纯活性CaCO3的流程如图3。(资料:氨水的pH约为11.7,氢氧化镁完全沉淀的pH约为10.87)
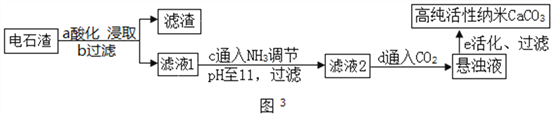
①步骤a中加入的药品为NH4Cl溶液,由此说明NH4Cl溶液呈________性(填酸性、中性或碱性);如图2为浓度对钙、镁元素浸出率的影响。由图可知NH4Cl溶液的质量分数达到10%以上主要溶解的是Ca(OH)2;浸取时主要发生反应的化学方程式为_________________。
②流程c通入NH3的目的主要有两个,一是调节溶液的pH值,二是_______。
③滤液1中通入NH3和CO2后生成碳酸钙和氯化铵,写出发生反应的化学方程式为________________。
④向滤液1中滴加Na2CO3溶液,也能得到CaCO3,从节约药品角度分析图3所示流程中可循环利用的物质有__________________(写出两种物质)。
【答案】 CaCO3![]() CaO+CO2↑ 900 2NH4Cl+Ca(OH)2=CaCl2+2H2O+2NH3↑ 使镁离子以氢氧化镁沉淀形式析出 CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl NH3 NH4Cl
CaO+CO2↑ 900 2NH4Cl+Ca(OH)2=CaCl2+2H2O+2NH3↑ 使镁离子以氢氧化镁沉淀形式析出 CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl NH3 NH4Cl
【解析】本题是流程题。主要考查了盐的化学性质,化学方程式的书写。在解此类题时,首先读懂流程,分析题中考查的问题,然后结合学过的知识和题中的提示进行解答。
(1)煅烧石灰石时,石灰石中的主要成分碳酸钙分解生成氧化钙和二氧化碳,反应的化学方程式为:CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
Ⅱ、由表中数据可知,上述温度中,900℃煅烧所得CaO活性最高。
(2)①步骤a中加入的药品为NH4Cl溶液,根据流程图中“酸化”可知,氯化铵溶液显酸性;浸取时,氯化铵和氢氧化钙反应生成氯化钙、水和氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2=CaCl2+2H2O+2NH3↑;
②氢氧化镁完全沉淀的pH约为10.87。流程C通入NH3的目的主要有两个,一是调节溶液的pH值,二是使镁离子以氢氧化镁沉淀形式析出;
③滤液1中存在氯化钙,通入NH3和CO2后生成碳酸钙和氯化铵,发生反应的化学方程式为:CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl;
④从节约药品角度分析图3所示流程的过程中产生的氨气,可用作滤液1后调节溶液的pH;滤液1中通入NH3和CO2后生成的氯化铵,可用作酸化过程,图3所示流程中可循环利用的物质有NH3和NH4Cl。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案