题目内容
【题目】以下是初中化学常见实验,请回答有关问题。
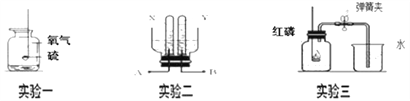
(1)实验一的集气瓶中预先加入少量水,其作用是_____;
(2)实验二为电解水的实验,其中 A 是与电源的_____极相连。实验开始时, X 和 Y 气体的体积比 大于 2:1,其可能原因是:_____(填序号);
①氧气溶解的更多 ②氢气溶解的更多 ③氧气的密度大 ④氢气的密度小
(3)实验三是测定空气中的氧气含量,假如集气瓶容积为 100mL,实验前已装水 20mL,则流进集气瓶内的水约是_____mL。该实验成功的关键是_____(填序号)。
①该装置气密性好 ②实验前夹紧止水夹 ③红磷过量或足量
④冷却后再打开止水夹 ⑤要选用教室内的空气 ⑥要将红磷慢慢伸入集气瓶中
【答案】 吸收二氧化硫,减少空气污染 负 ① 16 ①②③④
【解析】(1)硫燃烧生成二氧化硫污染空气,集气瓶中预先加入了少量水,其作用是吸收二氧化硫,污染空气;(2)该实验中用到的电源是直流电,与气体A相连产生的气体较多,所以是电源的负极,产生的是氢气;由于氧气的溶解性比氢气的大.所以,实验刚开始时,X和Y气体的体积比>2:1;(3)由于空气中氧气约占空气体积的![]() ,集气瓶容积为120mL,实验前已经装水20mL,剩余空气的体积是100mL,白磷燃烧消耗了氧气,等冷却后进入集气瓶的水约为20mL;该实验成功的关键因素是:装置气密性好、实验前夹紧止水夹、红磷过量或足量、冷却后再打开止水夹,选用实验室内的空气不是实验成功的关键。
,集气瓶容积为120mL,实验前已经装水20mL,剩余空气的体积是100mL,白磷燃烧消耗了氧气,等冷却后进入集气瓶的水约为20mL;该实验成功的关键因素是:装置气密性好、实验前夹紧止水夹、红磷过量或足量、冷却后再打开止水夹,选用实验室内的空气不是实验成功的关键。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】将4.0g Cu-Zn合金粉末放到盛有10g稀硫酸的烧杯中,恰好完全反应。过滤、称量滤液的质量。相关实验数据如下:
反应前物质的质量/g | 反应后物质的质量/g | |
Cu-Zn合金 | 稀硫酸 | 固体和液体的总质量 |
4.0 | 10 | 13.96 |
若不考虑该合金中除Cu、Zn以外的其他成分,请计算
(1)原Cu-Zn合金中Zn的质量为___________。
(2)所用稀硫酸中溶质的质量分数为___________。
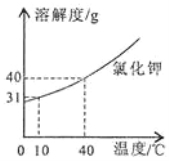
【题目】下表是不同温度时硝酸钾的溶解度,有关说法正确的是( )
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/克 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
A. 20℃时,100克硝酸钾饱和溶液中含硝酸钾31.6克
B. 40℃时硝酸钾饱和溶液中,溶质硝酸钾的质量分数为63.9%
C. 100℃的水能溶解的硝酸钾一定比80℃的水能溶解的硝酸钾多
D. 100℃时(100+246)克硝酸钾饱和溶液降温到60℃时,析出硝酸钾固体的质量为136克