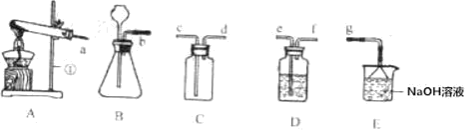题目内容
【题目】我国海域辽阔。海水可以晒盐,海水中也含有较多的镁元素,利用海水晒盐中的母液(含MgCl2)可以提取金属镁。下图是工业上利用海水提取镁的部分流程,请你回答。
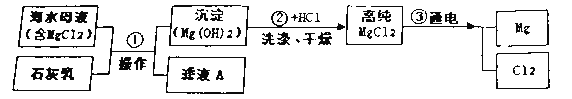
(1)第①步反应后进行分离操作的名称是_________。实验室进行该操作所需的玻璃仪器有烧杯、玻璃棒和__________________。
(2)写出第②步反应的化学方程式:_______________________。
(3)滤液A中一定含有的离子是_________(填离子符号,填一种即可)。
(4)步骤③的反应类型是____________。该反应是对熔融状态的MgCl2进行通电分解,反应时需要在一种特殊真空或有保护气的情况进行,可能原因是________________。
【答案】 过滤 漏斗 Mg(OH)2+2HCl=MgCl2+2H2O Ca2+或Cl- 分解反应 防止生成的镁在高温时遇空气氧化
【解析】(1)操作①将固液分离,故是过滤;过滤需要的玻璃仪器有玻璃棒,烧杯,漏斗;
(2)第②步反应是氢氧化镁与稀盐酸反应生成氯化镁和水,反应方程式为Mg(OH)2+2HCl=MgCl2+2H2O;
(3)海水中含有较多的氯化镁,镁离子与氢氧化钙反应生成了氢氧化镁沉淀, 故溶液中一定含有钙离子和氯离子;离子符号为Ca2+和Cl-
(4)步骤③是由一种物质反应生成多种物质,故是分解反应;镁是活泼的金属,易被氧化,故该实验要在一种特殊真空或有保护气的情况进行;

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案【题目】下列 4 个图像能正确反映对应变化关系是( )
A | B | C | D |
|
|
|
|
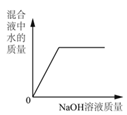
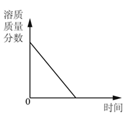
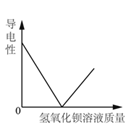
向一定量稀硫酸中加 入 NaOH 溶液 | 浓硫酸长期暴露在空 气中 | 向一定量的硫酸溶液 中逐滴滴入氢氧化钡 溶液至过量 | 相同条件下,加热质 量相等的两份固体,a 为氯酸钾和二氧化锰 的混合物,b 为氯酸 钾 |
A. A B. B C. C D. D