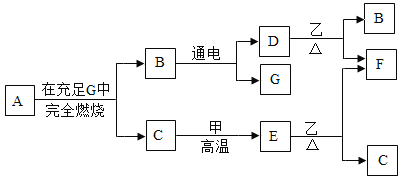
题目内容
【题目】某研究小组的同学为探究铁、铜、锌、银的金属活动性顺序,设计如图所示的三个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同)。
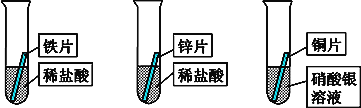
(1)通过观察,甲同学很快判断锌的活动性比铁强。据你分析,甲同学依据的实验现象是_____。过一会儿,他又发现铜片表面有银白色固体附着,这说明______,请写出反应方程式________。
(2)乙同学认为上述实验不足以得出四种金属的活动性顺序,想再补充一个实验,请你和乙同学一起设计一个实验方案并进行实验,达到探究目的。
实验步骤 | 实验现象 | 实验结论 |
______ | ______ | ______ |
(3)通过以上探究,四种金属的活动性由强到弱的顺序是:_______________。
【答案】锌片表面比铁片表面产生的气泡快 铜的活动性比银强 Cu+2AgNO3═Cu(NO3)2+2Ag 将用砂纸打磨过的铁片浸入硫酸铜溶液中,仔细观察 铁片表面有红色固体附着;说明铁的活动性比铜强 说明铁的活动性比铜强 锌>铁>铜>银
【解析】
本题考查金属的活动性顺序,要证明一种金属比另一种金属活泼,只要把一种金属放入另一种金属的盐溶液中,观察现象即可;对于实验设计方案的评价,要看能不能达到实验的目的,本题中第一和第二支试管中,都有气泡冒出,但是第二支试管中气泡产生的快,因此锌比铁活泼.第三只试管中,铜片表面有银白色固体附着,因此铜的活动性比银强;本题还需要证明铁和铜的活动顺序,要比较铁的性质比铜活泼,只要用铜的盐溶液即可,(也可以把铁和铜分别放入稀盐酸中)。
(1)本题中第一和第二支试管中,都有气泡冒出,但是第二支试管中气泡产生的快,因此锌比铁活泼;铜片表面有银白色固体附着,因此铜的活动性比银强,反应的方程式是:Cu+2AgNO3═Cu(NO3)2+2Ag;
(2)本题还需要证明铁和铜的活动顺序,要比较铁的性质比铜活泼,只要用硫酸铜溶液即可,具体方案为:将用砂纸打磨过的铁片浸入硫酸铜溶液中,仔细观察;铁片表面有红色固体附着;说明铁的活动性比铜强;
(3)通过以上探究,锌比铁活泼、铜的活动性比银强、铁的活动性比铜强。

 阅读快车系列答案
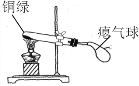
阅读快车系列答案【题目】兴趣小组同学发现实验室一片久置的铜片表面附着有一层绿色固体,查阅资料得知绿色固体是铜绿 [化学式为Cu2(OH)2CO3],甲同学从铜片上刮下一些铜绿进行如下探究,请填写下表中空白:
实验步骤 | 实验现象 | 实验结论 |
| 试管内壁有水雾。 | 铜绿加热产生_________。 |
_________________。 | 铜绿加热后生成氧化铜。 | |
气球胀大。 |
乙同学对气球胀大产生兴趣,于是进行了如下的探究。
(发现问题) 气球为什么会胀大?
(提出猜想) 猜想Ⅰ:试管内的空气受热膨胀使气球胀大;
猜想Ⅱ:铜绿加热产生二氧化碳使气球胀大;
猜想Ⅲ:铜绿加热产生一氧化碳使气球胀大;
猜想Ⅳ:铜绿加热产生一氧化碳和二氧化碳混合气体使气球胀大。
(实验与分析)①熄灭酒精灯后,气球依然胀大没有变瘪,证明猜想___________不成立。
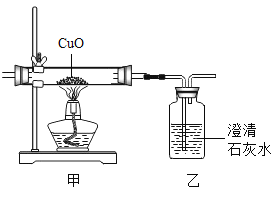
②乙同学用下图装置进行实验:
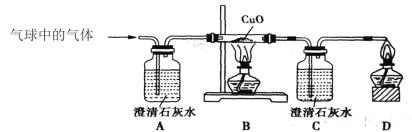
乙同学发现___________________,说明铜绿加热后有CO2产生,产生此现象的化学方程式是________,B处试管内的氧化铜没有变化,说明猜想___________不成立。
(实验结论)猜想Ⅱ成立。
(反思)
(1)加热铜绿反应的化学方程式是__________________。
(2)丙同学认为乙同学如果省略A可达到相同的结论,具体的操作是______________________。