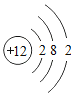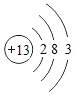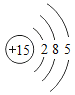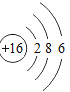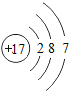题目内容
【题目】下图是家用白炽灯,请结合所学知识回答下列问题:
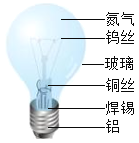
(1)白炽灯中含有金属元素的材料有_____________(写一种) ;
(2)在白炽灯中充入氮气的作用是______________。
(3)白炽灯的灯头是用铝而不用铁的,是由于铝具有很好的抗腐蚀性,原因是______________。
(4)铝比铁活泼,但是铝的抗腐蚀性却比铁强,请写出能证明铝比铁活泼的化学方程式_____________。
【答案】钨(或铜、焊锡、铝) 作保护气 铝表面会形成一层致密的氧化膜,阻止铝的进一步氧化 ![]()
【解析】
(1)白炽灯中含有金属元素的材料有钨(或铜、焊锡、铝);
(2)氮气的化学性质稳定,在白炽灯中充入氮气的作用是作保护气;
(3)白炽灯的灯头是用铝而不用铁的,是由于铝具有很好的抗腐蚀性,原因是铝表面会形成一层致密的氧化膜,阻止铝的进一步氧化;
(4)铝能与氯化亚铁反应生成氯化铝和铁,能证明铝比铁活泼,反应的化学方程式为:![]() 。
。

【题目】按下表进行试验,在等质量的大理石中加入足量的酸(假设杂质不与酸反应),用数字检测仪分别测得产生的二氧化碳体积随时间的变化曲线如图所示。根据图示,下列说法正确的是
实验编号 | 药 品 |
Ⅰ | 块状大理石、10%的稀硫酸溶液 |
Ⅱ | 块状大理石、7%的稀盐酸溶液 |
Ⅲ | 粉末状大理石、7%的稀盐酸溶液 |
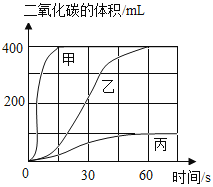
A.曲线甲代表的是实验I
B.实验室可用块状大理石和10%的稀硫酸溶液反应制取二氧化碳
C.实验室可用粉末状大理石和7%的稀盐酸溶液反应制取二氧化碳
D.据图分析,在其他条件相同时,固体的颗粒越小,反应速率越快
【题目】某研究小组的同学为探究铁、铜、锌、银的金属活动性顺序,设计如图所示的三个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同)。
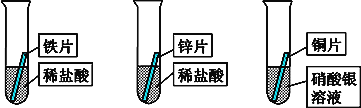
(1)通过观察,甲同学很快判断锌的活动性比铁强。据你分析,甲同学依据的实验现象是_____。过一会儿,他又发现铜片表面有银白色固体附着,这说明______,请写出反应方程式________。
(2)乙同学认为上述实验不足以得出四种金属的活动性顺序,想再补充一个实验,请你和乙同学一起设计一个实验方案并进行实验,达到探究目的。
实验步骤 | 实验现象 | 实验结论 |
______ | ______ | ______ |
(3)通过以上探究,四种金属的活动性由强到弱的顺序是:_______________。
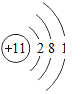
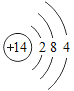
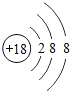
【题目】已知元素周期表中第三周期各元素原子结构示意图如下,下列分析错误的是
|
|
|
|
|
|
|
|
钠(Na) | 镁(Mg) | 铝(Al) | 硅(Si) | 磷(P) | 硫(S) | 氯(Cl) | 氩(Ar) |
A.第三周期的元素从左往右依次是金属元素、非金属元素和稀有气体元素
B.Na+和Mg2+的核外电子数不相同
C.Na与Cl形成化合物的化学式为NaCl
D.在化学反应中氯原子容易得到电子
【题目】某同学为了测定铜镁混合物中铜的质量分数,将100g稀盐酸分2次加入到盛有5g该固体混合物的烧杯中,所得数据如下表。(提示:铜镁混合物中的镁能和稀盐酸反应生成氯化镁和氢气,而铜不与稀盐酸反应、也不溶于水)则下列说法中错误的是( )
次数 | 实验前 | 第1次 | 第2次 |
加入稀盐酸的质量/g | 0 | 50 | 50 |
剩余固体的质量/g | 5 | 3 | 2 |
A.第1次加入稀盐酸后剩余固体中还有镁
B.第2次所加入的稀盐酸未反应完
C.每50g稀盐酸和1g镁恰好能完全反应
D.原混合物中铜的质量分数为40%
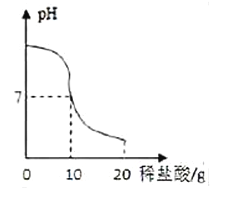
【题目】将20.0g稀盐酸逐滴加入到10.0g溶质质量分数为40%的氢氧化钠溶液中,边滴加边搅拌,随着稀盐酸的滴加,溶液的pH变化情况如图所示,溶液的温度变化如表所示(不考虑反应过程中热量散失)
反应时间(s) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
溶液温度(℃) | 20.5 | 20.6 | 20.7 | 20.8 | 20.9 | 20.8 | 20.7 |
(1)当稀盐酸与氢氧化钠溶液恰好完全反应时,溶液的温度是_____℃
(2)计算稀盐酸中溶质的质量分数_________(精确到0.1%)