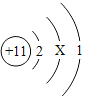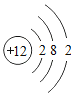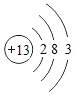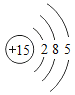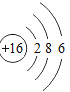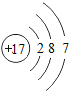题目内容
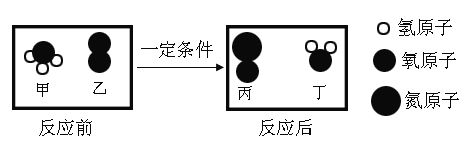
【题目】A、B、C、D、E、F、G七种物质有如下图所示的相互转化关系:已知:常温下,单质甲、化合物乙均为黑色固体,而F则为红色的固体单质,常用作导线,在空气中加热会生成黑色固体乙。A、C、D、E、G均为无色气体,且气体A中只含有两种元素,两种元素质量比为3:1,C常被称为温室效应气体。请回答下列问题:
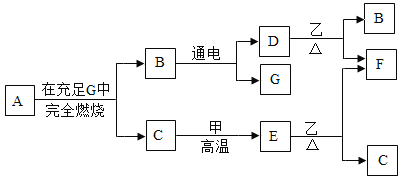
(1)写出A、乙两种物质的化学式:A._____;乙_____。.
(2)写出D与乙反应的化学方程式_____。
(3)写出A在充足G中完全燃烧的化学方程式:_____。
【答案】CH4 CuO CuO+H2![]() Cu+H2O
Cu+H2O 
【解析】
常温下,甲为黑色固体单质,则甲为碳,而F则为红色的固体单质,常用作导线,则F是铜,有良好的导电性;铜在空气中加热会生成黑色固体乙,则乙是氧化铜;A、C、D、E、G均为无色气体,且气体A中只含有两种元素,两种元素质量比为3:1,则A为甲烷(CH4);C常被称为温室效应气体,则C是二氧化碳;甲烷在G中充分燃烧产生二氧化碳和水,则G是氧气,B是水,水通电产生氢气和氧气,则D是氢气;二氧化碳与木炭高温反应生成一氧化碳,则E为一氧化碳,一氧化碳与氧化铜在加热条件下生成铜和二氧化碳,符合题意。
(1)由分析可知,A为甲烷:CH4;乙为氧化铜:CuO;
(2)氢气加热还原氧化铜生成铜和水的化学方程式:CuO+H2![]() Cu+H2O;
Cu+H2O;
(3)甲烷在氧气中充分燃烧产生二氧化碳和水的化学方程式:CH4+2O2![]() CO2+2H2O。
CO2+2H2O。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案【题目】某研究小组的同学为探究铁、铜、锌、银的金属活动性顺序,设计如图所示的三个实验(其中金属均已用砂纸打磨,且形状、大小相同;所用稀盐酸的溶质质量分数、用量也相同)。
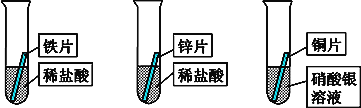
(1)通过观察,甲同学很快判断锌的活动性比铁强。据你分析,甲同学依据的实验现象是_____。过一会儿,他又发现铜片表面有银白色固体附着,这说明______,请写出反应方程式________。
(2)乙同学认为上述实验不足以得出四种金属的活动性顺序,想再补充一个实验,请你和乙同学一起设计一个实验方案并进行实验,达到探究目的。
实验步骤 | 实验现象 | 实验结论 |
______ | ______ | ______ |
(3)通过以上探究,四种金属的活动性由强到弱的顺序是:_______________。
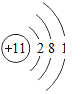
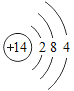
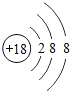
【题目】已知元素周期表中第三周期各元素原子结构示意图如下,下列分析错误的是
|
|
|
|
|
|
|
|
钠(Na) | 镁(Mg) | 铝(Al) | 硅(Si) | 磷(P) | 硫(S) | 氯(Cl) | 氩(Ar) |
A.第三周期的元素从左往右依次是金属元素、非金属元素和稀有气体元素
B.Na+和Mg2+的核外电子数不相同
C.Na与Cl形成化合物的化学式为NaCl
D.在化学反应中氯原子容易得到电子
【题目】某同学为了测定铜镁混合物中铜的质量分数,将100g稀盐酸分2次加入到盛有5g该固体混合物的烧杯中,所得数据如下表。(提示:铜镁混合物中的镁能和稀盐酸反应生成氯化镁和氢气,而铜不与稀盐酸反应、也不溶于水)则下列说法中错误的是( )
次数 | 实验前 | 第1次 | 第2次 |
加入稀盐酸的质量/g | 0 | 50 | 50 |
剩余固体的质量/g | 5 | 3 | 2 |
A.第1次加入稀盐酸后剩余固体中还有镁
B.第2次所加入的稀盐酸未反应完
C.每50g稀盐酸和1g镁恰好能完全反应
D.原混合物中铜的质量分数为40%