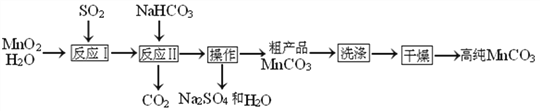
题目内容
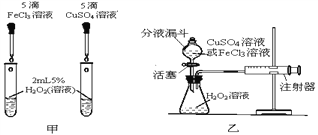
【题目】为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的催化效果,某研究小组进行了如下探究:
(1)请写出H2O2分解的化学方程式_______________。
(定性研究)(2)如图甲,可通过观察__________来定性比较两者的催化效果。
(定量研究)(3)要定量比较两者的催化效果,可测量生成等体积气体所需的____________。
(深入研究)(4)在CuSO4溶液中,究竟是哪种粒子起催化作用呢?
猜想1:铜离子(Cu2+)起催化作用;
猜想2:___________起催化作用;
猜想3:___________起催化作用;
(注意:若答对第(5)小题奖励4分,化学试卷总分不超过60分。)
(5)请设计实验,验证猜想1
实验操作 | 实验现象及结论 |
_______________ | ______________ |
【答案】 2H2O2![]() 2H2O+O2↑ 产生气泡的快慢 时间 SO42- H2O 分别取同温度同体积同浓度的H2O2溶液于2支试管中,再分别加入等质量的CuSO4和H2SO4。观察现象。 加入CuSO4的试管中产生的气体快,加入H2SO4的试管中产生的气体慢。证明是Cu2+起作用。
2H2O+O2↑ 产生气泡的快慢 时间 SO42- H2O 分别取同温度同体积同浓度的H2O2溶液于2支试管中,再分别加入等质量的CuSO4和H2SO4。观察现象。 加入CuSO4的试管中产生的气体快,加入H2SO4的试管中产生的气体慢。证明是Cu2+起作用。
【解析】本题考查了探究催化剂特点,根据控制变量原理,反应速率测定原理及影响反应速率的因素进行分析。
(1)过氧化氢在催化剂的作用下分解为氧气和水,反应的化学方程式是2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)要定性比较相同浓度的FeCl3(氯化铁)溶液和CuSO4(硫酸铜)溶液对H2O2分解的催化效果,可以通过观察产生气泡的快慢进行比较;
(3)要定量比较相同浓度的FeCl3(氯化铁)溶液和CuSO4(硫酸铜)溶液对H2O2分解的催化效果,可以通过测量生成等体积气体所需的时间;
(4)在CuSO4溶液中存在Cu2+、SO42-、H2O。所以猜想2:SO42-起催化作用;猜想3:H2O起催化作用;
(5)检验是否是铜离子起催化作用,可以选择含的硫酸根离子溶液来进行检验。所以
实验操作 | 实验现象及结论 |
分别取同温度同体积同浓度的H2O2溶液于2支试管中,再分别加入等质量的CuSO4和H2SO4。观察现象。 | 加入CuSO4的试管中产生的气体快,加入H2SO4的试管中产生的气体慢。证明是Cu2+起作用。 |

【题目】铅蓄电池在生产、生活中使用广泛。其构造示意图如图1,回答下列问题:
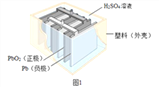
(1)图1铅蓄电池放电过程中,反应的化学方程式为 Pb+PbO2+2H2SO4═2PbSO4+2H2O,据此可知,铅蓄电池在放电时,溶液的pH不断_____(填“增大”、“减小”或“不变”)。
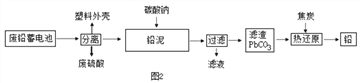
(2)如图2是回收废铅蓄电池的一种工艺流程。
①写出焦炭热还原生成铅的化学方程式: ________________________
②将流程图中的废硫酸和滤液按一定比例混合,再将所得的混合液经____、降温结晶、过滤等操作,可以析出Na2SO4·10H2O晶体。
③如表是一些金属熔点的数据:
金属 | 锡 | 铅 | 铋 | 镉 |
熔点∕℃ | 231.9 | 327.5 | 271.3 | 320.9 |
日常所用保险丝由铋、铅、锡、镉等金属组成,其熔点约为________________。
A. 231.9-327.5℃ B.271.3-320.9℃ C.60-80℃ D.20-40℃
④废硫酸直接排放会污染环境,拟选用如表物质中和后再排放:
物质 | CaCO3 | NH3 | Ca(OH)2 |
市场参考价(元/kg ) | 1.8 | 6.5 | 2.0 |
已知:2NH3+H2SO4═(NH4)2SO4,如果要求花最少的钱来中和等质量、等浓度的废硫酸,则应选择_________ 。