题目内容
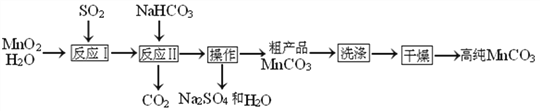
【题目】实验室以MnO2为原料制备少量高纯MnCO3的流程如下:
已知:①反应Ⅰ的化学方程式:MnO2+SO2═MnSO4;②MnCO3、Mn(OH)2均难溶于水,MnCO3在100℃时开始分解.
(1)MnCO3中Mn的化合价是________.
(2)流程中“操作”的名称为_____,所需要的主要玻璃仪器有_____(写一种即可).
(3)反应Ⅱ的化学方程式为________________.反应Ⅱ需控制溶液的酸碱性,若碱性过强,MnCO3粗产品中将混有_____________(填化学式).
(4)检验“洗涤a”已洗净的方法是______________________.
(5)为获得高纯MnCO3,需选择“低温”干燥的原因是_____.
【答案】 +2 过滤 漏斗或玻璃棒或烧杯 2NaHCO3 + MnSO4 == Na2SO4 + MnCO3 ↓+ H2O +CO2 ↑ Mn(OH)2 取最后一次洗涤液,滴加氯化钡溶液,无明显现像,说明已洗净 防止 MnCO3 分解
【解析】(1)根据化合物中各元素正负化合价代数和为0解答;(2)根据分离固液混合物的方法是过滤及所需仪器解答;(3)根据碳酸氢钠溶液与硫酸锰反应生成硫酸钠、碳酸锰、水和二氧化碳解答;根据碱性过强,则硫酸锰和碱反应生成难溶性氢氧化锰沉淀解答;(4)根据若溶液已洗净,则溶液中不含碳酸锰解答;(5)根据MnCO3在100℃时开始分解解答。(1)MnCO3中碳酸根显-2价,则Mn的化合价是+2;(2)流程中“操作”的名称为过滤,所需要的主要玻璃仪器有漏斗(或玻璃棒或烧杯);(3)反应Ⅱ中加入的是反应I的生成物硫酸锰和新加入的碳酸氢钠,生成物为过滤得到的碳酸锰和溶液中的硫酸钠以及生成的气体二氧化碳,反应的化学方程式为 MnSO4+2NaHCO3=Na2SO4+MnCO3↓+CO2↑+H2O;反应Ⅱ需控制溶液的酸碱性,若碱性过强,则硫酸锰和碱反应生成难溶性氢氧化锰沉淀,对应的化学式为Mn(OH)2;(4)检验“洗涤a”已洗净的方法是取最后一次洗涤液,滴加氯化钡溶液,无明显现像,说明已洗净;(5)为获得高纯MnCO3,需选择“低温”干燥的原因是防止 MnCO3 分解。

 世纪百通期末金卷系列答案
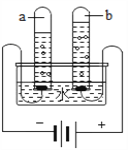
世纪百通期末金卷系列答案【题目】某研究小组为探究“影响铁制品锈蚀快慢的因素”,取同浓度的稀氨水和稀醋酸,用右图装置完成表中实验,回答下列问题。
![]()
实验序号 | ① | ② | ③ | ④ |
实验温度/℃ | 25 | 25 | 70 | 70 |
试剂 | 稀氨水 | 稀醋酸 | 稀氨水 | 稀醋酸 |
出现铁锈 所需时间 | 1天 未见锈蚀 | 5分钟 | 1天 未见锈蚀 | 1分钟 |
(1)铁锈的主要成分是________(填化学式)。
(2)实验②和④可探究________因素对铁制品锈蚀快慢的影响;欲探究试剂酸碱性对铁制品锈蚀快慢的影响,应选择的实验是______________(填实验序号)。
(3)根据表中实验现象得出的结论是_________________(写出1点即可)。
(4)影响铁制品的锈蚀快慢除上述因素外,还有______________________(写出1点即可),请设计实验方案_________________________________________________。
【题目】为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的催化效果,某研究小组进行了如下探究:
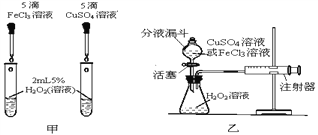
(1)请写出H2O2分解的化学方程式_______________。
(定性研究)(2)如图甲,可通过观察__________来定性比较两者的催化效果。
(定量研究)(3)要定量比较两者的催化效果,可测量生成等体积气体所需的____________。
(深入研究)(4)在CuSO4溶液中,究竟是哪种粒子起催化作用呢?
猜想1:铜离子(Cu2+)起催化作用;
猜想2:___________起催化作用;
猜想3:___________起催化作用;
(注意:若答对第(5)小题奖励4分,化学试卷总分不超过60分。)
(5)请设计实验,验证猜想1
实验操作 | 实验现象及结论 |
_______________ | ______________ |