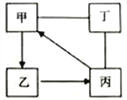
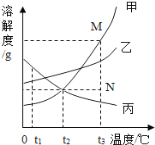
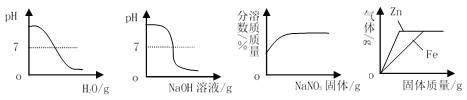
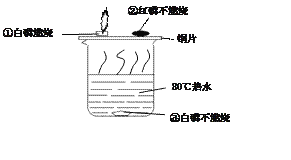
题目内容
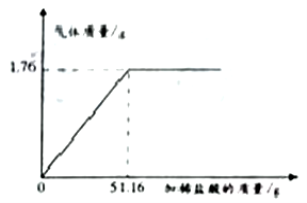
【题目】某石灰厂需要测定产品生石灰中杂质(杂质只含CaCO3)的质量分数.小刚进行了如图实验.请计算:
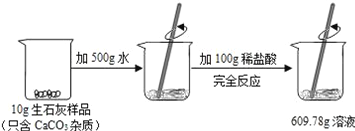
(1)生成CO2气体的质量;
(2)样品中CaCO3的质量分数.
【答案】0.22g.
@5%.
【解析】(1)反应前药品的总质量为500g+100g+10g=610g,反应后样品的总质量为609.78g ,根据质量守恒定律,生成二氧化碳的质量为:610g-609.78g=0.22g;
(2)设生成0.22g的二氧化碳气体需要碳酸钙的质量为x
CaCO3+2HCl == CaCl2+H2O+CO2↑
100 44
x 0.22g
![]() =
=![]() x=0.5g
x=0.5g
样品中CaCO3的质量分数=![]() =5%
=5%
答:生成二氧化碳的质量为0.22g,样品中碳酸钙的质量分数为5%。

练习册系列答案
相关题目
【题目】为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的催化效果,某研究小组进行了如下探究:
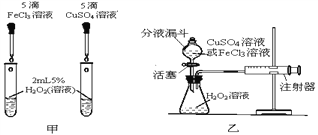
(1)请写出H2O2分解的化学方程式_______________。
(定性研究)(2)如图甲,可通过观察__________来定性比较两者的催化效果。
(定量研究)(3)要定量比较两者的催化效果,可测量生成等体积气体所需的____________。
(深入研究)(4)在CuSO4溶液中,究竟是哪种粒子起催化作用呢?
猜想1:铜离子(Cu2+)起催化作用;
猜想2:___________起催化作用;
猜想3:___________起催化作用;
(注意:若答对第(5)小题奖励4分,化学试卷总分不超过60分。)
(5)请设计实验,验证猜想1
实验操作 | 实验现象及结论 |
_______________ | ______________ |