题目内容
(5分)钠的化合物在日常生活中应用广泛。
(1)在元素周期表中,钠元素的信息如图所示,钠元素的相对原子质量为_____。
(2)氢氧化钠可用于制杀虫剂,氢氧化钠的俗名是_____(写一种)。
(3)次氯酸钠(NaClO)是84消毒液的有效成分,次氯酸钠中氯元素的化合价为_____。
(4)碳酸氢钠是发酵粉的主要成分,碳酸氢钠与盐酸反应的化学方程式为_________。
(5)氨基钠(NaNH2)是合成维生素A的原料。工业上生产氨基钠的化学反应方程式为
2Na + 2NH3△2NaNH2 + H2↑,该反应属于基本反应类型中的_______反应。
(1)22.99 (2)火碱(烧碱、苛性钠) (3)+1
(4)NaHCO3 + HCl NaCl+ H2O + CO2↑ (5)置换
解析试题分析:(1)根据元素周期表方格中的信息,可知钠元素的相对原子质量为22.99
(2)氢氧化钠具有强烈的腐蚀性,俗称:火碱(烧碱、苛性钠)
(3)根据化合价的一般规律:在化合物中,正负化合价的代数和为0,次氯酸钠(NaClO)中Na的化合价为+1,O的化合价为-2,所以氯元素的化合价为+1
(4)碳酸氢钠与盐酸反应的化学方程式为:NaHCO3 + HCl NaCl+ H2O + CO2↑
(5)化学反应方程式为2Na + 2NH3△2NaNH2 + H2↑,符合一种单质和一种化合物反应生成另一种单质和另一种化合物的特点,属于置换反应
考点:元素周期表方格中的信息,物质的俗名,化合价的一般规律,化学方程式的书写,化学反应基本类型

 名校课堂系列答案
名校课堂系列答案关于硫酸的性质实验
① 下图是某同学组建的实验室稀硫酸与锌混合制取氢气的装置。
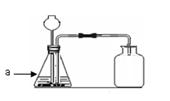 |
回答:a仪器的名称是 ;装置中用于添加液体的仪器名称是 ;装置中出现 处错误。若按照上述装置制取氢气会造成的后果是 。
②稀硫酸与含少量氧化铁的铁粉反应实验:下图是反应的实验过程。(装置气密性良好)


写出铁与硫酸反应的化学方程式 。以上U型管中红墨水变化情况符合该实验的是 。(填写序号)
③ 中和反应实验:氢氧化钠与硫酸反应无明显现象。为了证明氢氧化钠与硫酸确实发生了化学反应,进行了如下实验:

取2mLNaOH溶液于试管中,滴入1~2滴酚酞试剂,振荡。然后,逐滴加入稀硫酸,同时不断振荡试管,整个实验过程的现象是 。由此证明,上述实验过程确实发生了化学反应。反应的化学方程式是 。
(11分)废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),动物饲料硫酸亚铁的生产工艺之一如下图所示:
(1)在反应器中发生反应的化学方程式除Fe2(SO4)3+Fe=3FeSO4外还有: ; 。
(2)滤液M中肯定含有的溶质的化学式是 ;
(3)在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和 ;
(4)滤液M经过操作B可得硫酸亚铁晶体(FeSO4·7H2O)。已知硫酸亚铁的溶解度和析出晶体的组成如下表:
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 |
| 析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | |||||||
根据溶解度表,硫酸亚铁晶体(FeSO4·7H2O)冷却结晶温度最高不超过 ℃;
(5)在化学反应中,若有元素化合价变化的反应定义为氧化还原反应。下列反应类型肯定是氧化还原反应的是 (填字母编号);
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
在氧化还原反应中,若有元素的化合价升高,必有元素的化合价降低,且元素化合价升降总数相等。
将无水硫酸亚铁(FeSO4)隔绝空气加强热,分解产物有三氧化二铁和另两种氧化物,试写出该反应的化学方程式 。