题目内容
海洋资源十分丰富,以下是对海水资源的部分利用.
(1)海水晒盐是利用经 _________ 方法获得粗盐的.
(2)实验室中,进行“粗盐中难溶性杂质的去除”实验的主要步骤是 _________ ,其中,用酒精灯加热所得滤液时,当 _________ 时就停止加热.
(3)除去泥沙后的食盐中往往还含有少量的硫酸钠、氯化镁、氯化钙等杂质.为将这些杂质除净,先将食盐溶于水,然后再进行如下操作即可得到较纯的氯化钠:①过滤;②蒸发③加过量的NaOH溶液;④加适量的盐酸;⑤加过量的Na2CO3溶液;⑥加过量的BaCl2溶液.正确的操作顺序是 _________ (填序号).其中,加过量的Na2CO3溶液的目的 _________ .实验中,判断滴加的盐酸“适量”的依据是 _________ .
(4)在以上操作中,过滤前所得溶液的溶质为 _________ (写化学式),若向此溶液滴加酚酞溶液,溶液呈 _________ 色.
(1)蒸发溶剂(蒸发结晶)
(2)溶解、过滤、蒸发、计算产率 较多量固体(剩余较少量液体)
(3)③⑥⑤①④② 除去过量的钡离子和钙离子 滴加盐酸至刚好无气泡放出为止
(4)氯化钠、氢氧化钠、碳酸钠 红色
解析试题分析:(1)因为氯化钠的溶解度随温度的变化不大,所以海水晒盐是利用经蒸发结晶方法获得粗盐
(2)实验室中,进行“粗盐中难溶性杂质的去除”实验的主要步骤是:溶解、过滤、蒸发、计算产率,用酒精灯加热所得滤液时,当出现较多量固体(剩余较少量液体)时就停止加热,利用余热蒸干,防止加热是固体飞溅,使产率偏低
(3)⑤加过量的Na2CO3溶液,主要是除氯化钙杂质,同时还除过量的BaCl2,所以第⑤步一定要放在第⑥步之后,④加适量的盐酸,是将前面过量的NaOH的过量的Na2CO3,所以应放在①过滤之后,所以正确的操作顺序是③⑥⑤①④②,其中,加过量的Na2CO3溶液的目的是:除去过量的钡离子和钙离子,因为在既有NaOH,又有Na2CO3的混合溶液中,加入稀盐酸,是先和NaOH反应,再与Na2CO3反应,所以判断滴加的盐酸“适量”的依据是:滴加盐酸至刚好无气泡放出为止
(4)根据上面的分析,过滤前所得溶液的溶质为:氯化钠、氢氧化钠、碳酸钠,其中氢氧化钠、碳酸钠溶液都呈碱性,所以向此溶液滴加酚酞溶液,溶液呈红色
考点:粗盐的提纯,物质的除杂

如图是某保健品标签的部分内容,请仔细阅读后回答下列问题。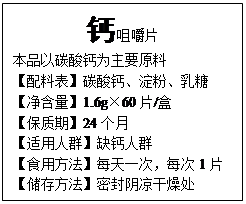
(1)该保健品的配料表中,能提供钙元素的物质是 。
(2)服用该保健品后,有时会出现腹胀、打嗝等反应,出现这种反应的
原因是 (用化学方程式表示)。
“无土栽培”是一项利用化学试剂配成的营养液来栽培植物的新技术,某营养液所含的成分有硝酸钙、硝酸钾、磷酸二氢铵、氯化钾、磷酸二氢钾、过磷酸钙,其中属于复合肥料的是( )
| A.硝酸钙 Ca(NO3)2 | B.磷酸二氢铵 NH4H2PO4 |
| C.氯化钾 KCl | D.______________________ |
(5分)下列各组中的两种反应物混合,回答下列问题:
(1)根据实验事实完成下表:
| 编号 | 反应物1 | 反应物2 | 化学方程式 |
| 1 | 稀硫酸 | 氢氧化钡溶液 | |
| 2 | 硫酸钠溶液 | 氯化钡溶液 | |
| 3 | 硫酸铜溶液 | 硝酸钡溶液 | |

