��Ŀ����
����Ŀ��ij��ѧ��ȤС���ͬѧ���տα���ʵ��װ�������ⶨ���������������������ʵ�飨ͼ1��������������������������С�� ![]() ���������̽���� ��������⡿
���������̽���� ��������⡿
�������ԭ����ʲô����θĽ��α�ʵ��װ�ã�
���������ϡ�
��ɫ��״̬ | �۵�/�� | �Ż��/�� | �ܶ�/gcm��3 | |
���� | ����ɫ���� | 590 | 240 | 2.34 |
���� | ��ɫ���ɫ���� | 44.1 | 40 | 1.82 |
��1������������衿 ��ͬѧ�������ǵ�����ԭ���п������������������ˮ��Ӱ��ʵ���ȷ�ԣ�
��ͬѧ��������ƿ�ڲ��������л���������Ե�ʣ�
�㻹�����IJ����� ��
�����������ۡ�
��ͬѧ��Ϊ����ľ̿������ף��Ϳ�����������������Ϊ��ͬѧ�IJ��벻������������ ��
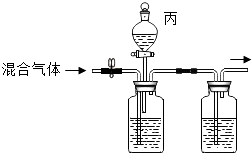
��2�����ǶԿα�ʵ��װ�ý�������ͼ2�ĸĽ��� �ټ�ͬѧ���Ӧ�Ѻ�����Ϊ���ף���������
��ͨ����ͭ˿����ȼ�������ڵİ��ף������˽���ͭ���ԣ�
����α�ʵ��װ����ȣ���װ�õ�һ���ŵ��� ��
��3����̽���뷴˼�� Ϊ��֤��ͬѧ�IJ��룬��ͭ���ڲ��������м��ȣ��۲쵽ͭ�۱�ڣ�������ͬѧ�IJ�����ѡ�������������������
��4����Ҳ��øĽ���ʵ��װ�ã�ͼ2������ʵ�飬����������ȴ�����ڰ�ɫ����Ļ��ʧ�����Һ��������1�õ��˽�ȷ�����ݣ��������ⷢ���������ڱ��϶˸��Ż�ɫ���壮 ���������϶˵Ļ�ɫ������Ҫ�ɷֿ�������
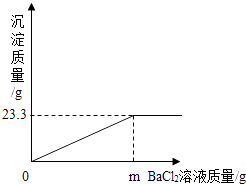
���������·���Һ��pH7���=������������������������ �� 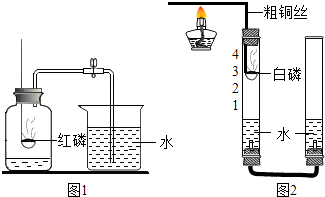
���𰸡�
��1��װ��©��������ƿδ��ȴ�����¾ʹ��˵��ɼУ����ײ���ȣ�ľ̿���Ժ�������Ӧ���ɶ�����̼���壬���ܲ���ѹǿ��
��2�������Ż��ͣ����Խ����ķ���ȼ�գ����ȣ����������ɵ������������ж�������Ⱦ�����������������ݱȽ�ȷ�������Լ����٣���ԼҩƷ��
��3������
��4�����ף���������������������ˮ����������
���������⣺����������衿����ƿδ��ȴ�����¾ʹ��˵��ɼ�Ҳ�ᵼ�²������ƫС���������ǿ�������IJ���Ϊ��װ��©��������ƿδ��ȴ�����¾ʹ��˵��ɼУ����ײ���ȣ������������ۡ���1��ľ̿���Ժ�������Ӧ���ɶ�����̼���壬���ܲ���ѹǿ�����ˮ���ܽ�����ƿ�ж����ܲⶨ�������������ĺ�������2���ٰ����Ż��ͣ����Խ����ķ���ȼ�գ���ͭ���нϺõĵ����ԣ����Ա�ʵ������������ͭ�ĵ����ԣ��۷���ͼ2�е�װ�û��������ɵ������������ж�������Ⱦ�����������������ݱȽ�ȷ�������Լ����٣���ԼҩƷ�ȣ� ��̽���뷴˼����1��ͭ�ۿ��Ժ�������Ӧ���ɺ�ɫ������ͭ���壬�������۲쵽ͭ�۱����˵��װ�ò���������������ͬѧ�IJ����������2���ٸ��ݡ��������ϡ�����֪��������Ϊ��ɫ���ɫ���壬�����������϶˵Ļ�ɫ������Ҫ�ɷֿ����ǰ���������������ĸ����ڲ������ϵģ�������������������ˮ���������ᣬ������pHС��7��
���Դ��ǣ�����������衿����ƿδ��ȴ�����¾ʹ��˵��ɼУ������������ۡ���1��ľ̿���Ժ�������Ӧ���ɶ�����̼���壬���ܲ���ѹǿ�2���ٰ����Ż��ͣ����Խ����ķ���ȼ�գ��ڵ��ȣ������ܱյĻ����н��з�Ӧ���ܹ�����ʵ����
��̽���뷴˼����1����������2���ٰ��ף��ڣ�������������������ˮ���������ᣮ

 ���ѵ����Ԫ��ĩ���100��ϵ�д�
���ѵ����Ԫ��ĩ���100��ϵ�д� ��˼άС�ھ�100����ҵ��ϵ�д�
��˼άС�ھ�100����ҵ��ϵ�д� ��ʦָ��һ��ͨϵ�д�
��ʦָ��һ��ͨϵ�д�����Ŀ���ں�ۡ��ۺͷ���֮�佨����ϵ�ǻ�ѧѧ�Ƶ��ص㣮A��B��C��D��ʾ4�����ʣ����ǵ���ʾ��ͼ���±���
���� | A | B | C | D |
|
��ʾ��ͼ |
|
|
|
|
��1��D��������������ӡ�����ԭ�ӡ������ӡ������ɵģ�
��2������A������B�ڵ�ȼ�����·�Ӧ����C��D�������ʣ���Ӧ�Ļ�ѧ����ʽ�� �� �������Ӧ������ ��
��3������������ʾ��ͼ����Ӧ�Ļ�ѧ����ʽ�����õĹ��ڻ�ѧ�仯��һ����Ϣ�ǣ������۽Ƕ���������
����Ŀ��ijʵ��С���ͬѧΪ���о�MnO2��H2O2�ֽⷴӦ�е����ã�����������̽���� ���������ϡ���MnO2+4HCl��Ũ�� ![]() MnCl2+2H2O+Cl2����Cl2��������Ϊ����ɫ���壬�д̼�����ζ����H2O2��ҺΪ��ɫҺ�壬�ڳ������ܻ����ֽ�ų��������������ڼ��Ȼ��д������ڵ��������ܿ��ٷֽ��������
MnCl2+2H2O+Cl2����Cl2��������Ϊ����ɫ���壬�д̼�����ζ����H2O2��ҺΪ��ɫҺ�壬�ڳ������ܻ����ֽ�ų��������������ڼ��Ȼ��д������ڵ��������ܿ��ٷֽ��������
�����ʵ�顿�ڳ�����ȡһ������H2O2��Һ������һ��ʱ���ܿ��������ų����������ݣ�����4gMnO2��ĩ����Ѹ�ٷų��������ݣ����ٲ������ݺ���Ӧ������ʹ��ˣ�������ϴ�Ӻ�ɣ��Ƶ�������Ϊ4g��
����������ۡ�
��1������ʵ��������й����ݣ�����MnO2��H2O2�ķֽ����ʣ����������ڷ�Ӧǰ��û�иı䣬Сǿ��ΪMnO2��H2O2�ֽⷴӦ����������
��2�����ݴ����ĸ��С����Ϊ����ʵ�黹������֤��MnO2��H2O2�ֽⷴӦ�еĴ���������ϵ�������ϲ���������ʵ�飬����������ʵ�鱨�棺
ʵ����� | ʵ������ | ʵ����� |
ȡʵ�������������Թ��У���������Ũ���Ტ���� | ������ΪMnO2 |
С�յ�ʵ��˵������H2O2�ֽⷴӦ��MnO2�����䣮�ۺ�Сǿ�ķ�����ʵ�����ȷ����MnO2��H2O2�ֽⷴӦ�Ĵ�����
��3����ʵ���У�ȡ��MnO2��ĩ�õ���һ�������� �� ��MnO2������ʱ��H2O2�ֽ�Ļ�ѧ����ʽΪ �� MnO2������2����Ӧ�зֱ���������Ӧ�����ijЩ��Ӧ�л��������������д��һ������������Ļ�ѧ����ʽ��