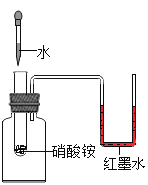
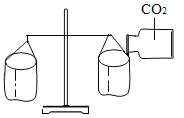
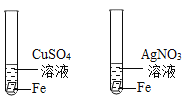
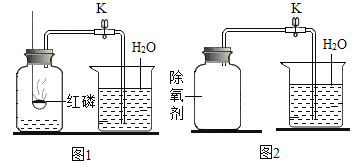
题目内容
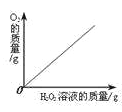
【题目】下图是硝酸钾的溶解度曲线。

(1)欲将一瓶接近饱和的硝酸钾溶液,在浓度不变的情况下变成饱和溶液,可采取的方法是_____;
(2)小明在20℃时进行了如下实验,得到相应的溶液①~⑤,下列说法正确的是_____。

A ④中溶质的质量分数最大 B ②⑤中溶质的质量分数相等
C ①③④中没有固体存在 D ②④⑤的溶液为饱和溶液
【答案】降温 ABC
【解析】
(1)饱和溶液是在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。由图可知,硝酸钾的溶解度随温度升高而增大,欲将一瓶接近饱和的硝酸钾溶液,在浓度不变的情况下变成饱和溶液,可采取的方法是降温;
(2)A、在20℃时进行了如下实验,①~⑤的溶液中,溶剂质量相同,④中溶质的质量最大,溶质的质量分数最大,选项正确;
B、20℃时,硝酸钾的溶解度为31.6g,②⑤都是20℃时的饱和溶液,溶质的质量分数相等,选项正确;
C、20℃时,硝酸钾的溶解度为31.6g,①中溶质质量20g能完全溶解,无固体存在;50℃时,硝酸钾的溶解度为85.5g,③中加入固体共50g,能完全溶解,无固体存在;④中加入固体共80g,完全溶解,没有固体存在,选项正确;
D、 50℃时,硝酸钾的溶解度为85.5g,④中只溶解50g,溶液为不饱和溶液,选项错误。
故选ABC。

 阳光试卷单元测试卷系列答案
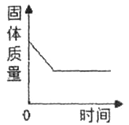
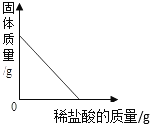
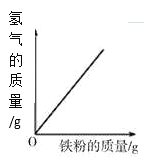
阳光试卷单元测试卷系列答案【题目】下列图象能正确反映对应变化关系的是( )
|
|
|
|
A.向一定量的二氧化锰中加入过氧化氢溶液 | B.将铁钉加入硫酸铜溶液中 | C.向一定量的大理石(杂质不参加反应)中加入足量的稀盐酸 | D.向一定质量的稀盐酸中加入足量铁粉 |
A. A B. B C. C D. D
【题目】为探究盐酸的化学性质,某化学小组做了如下实验:
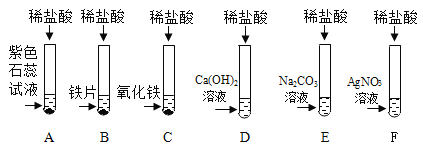
(1)上述反应中无现象的为_______(填字母序号,下同),有白色沉淀出现的是_______;B试管中所发生反应的化学方程式为_______________________________。
(2)将反应后D和E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质的成分进行
探究。
(提出问题)滤液中溶质的成分是什么?
(假设与猜想)猜想一:NaCl 猜想二:NaCl和CaCl2
猜想三:NaCl、Ca(OH)2和HCl 猜想四:_____
(讨论与交流)经讨论,同学们一致认为猜想________是错误的。
(实验与结论)
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,滴加适量碳酸钠溶液 | 无现象 | 猜想四成立 |
取少量滤液于试管中,滴加适量____ | _______ |
(拓展与迁移)稀盐酸和稀硫酸有相似的化学性质,是因为它们的溶液中都存在__________。
【题目】黄铜是铜和锌的合金。某化学兴趣小组的同学欲测定实验室中某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。称量10g粉末状黄铜样品放入烧杯中,量取45mL稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 | 第二次 | 第三次 | |
加入稀硫酸的体积(mL) | 15 | 15 | 15 |
生成氢气的质量(g) | m | 0.04 | 0.02 |
试求:
(1)m的数值_____。
(2)此黄铜样品中铜的质量分数是少?_____(写出计算过程)